東京理科大学
【
研究の要旨とポイント】
パラジウム触媒を用いたアクリルアミド類に対するanti-Michael型付加反応の開発に成功しました。
広範な基質に適用可能であり、ラージスケールでの反応や、配向基の除去なども容易に行うことができます。
本反応は、α-置換カルボニル化合物を一段階かつ原子効率100%で合成できる理想的な反応として、有機合成や医薬品分野での応用が期待されます。
【研究の概要】
東京理科大学 理学部第一部応用化学科の松田 学則教授、鈴木 弘嗣助教(2018年4月-2022年9月、現 福井大学 基盤部門テニュアトラック推進本部工学系重点領域 助教)、東京理科大学大学院 理学研究科化学専攻の茂呂 諒太氏(2024年度 修士課程2年)の研究グループは、医薬品等に多く見られるα-置換カルボニル化合物(*1)を効率的に合成できる、パラジウム触媒を用いたアクリルアミド類に対するanti-Michael型付加反応(*2)の開発に成功しました。
アクリルアミドなどのα,β-不飽和カルボニル化合物(*3)に対し求核剤を反応させると、通常1,2-付加もしくは1,4-付加反応(Michael付加反応)が進行します。一方でα位への求核付加反応であるanti-Michael型付加反応は、アクリルアミドの電子的要因から非常に困難でした。今回本研究グループは、配向基を導入したα,β-不飽和カルボニル化合物をパラジウム触媒存在下で反応させることにより、反応中間体を安定化させ、anti-Michael型付加反応を実現しました。
本研究では、触媒量のPd(OCOCF3)2(トリフルオロ酢酸パラジウム)存在下において、配向基として8-アミノキノリル基をもつアクリルアミドに対するインドールの anti-Michael型付加反応が進行し、高収率で付加生成物を与えることを見出しました。本反応は数多くのインドールの他にも、ピロールやチオフェンなどの複素環化合物や、電子豊富な芳香族化合物などさまざまな求核剤においても適用することができました。また配向基である8-アミノキノリル基は、カルボン酸や他のアミドなどに変換可能であり、本反応の有用性を示せました。
anti-Michael型付加反応は、医薬品等に多いα-置換カルボニル化合物を一段階かつ原子効率100%で合成できる理想的な反応として、今後広範な分野での応用が期待されます。
本研究成果は、2024年5月14日に国際学術誌「Journal of the American Chemical Society」にオンライン掲載されました。
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(
https://www.tus.ac.jp/today/archive/20240711_0847.html)をご参照ください。
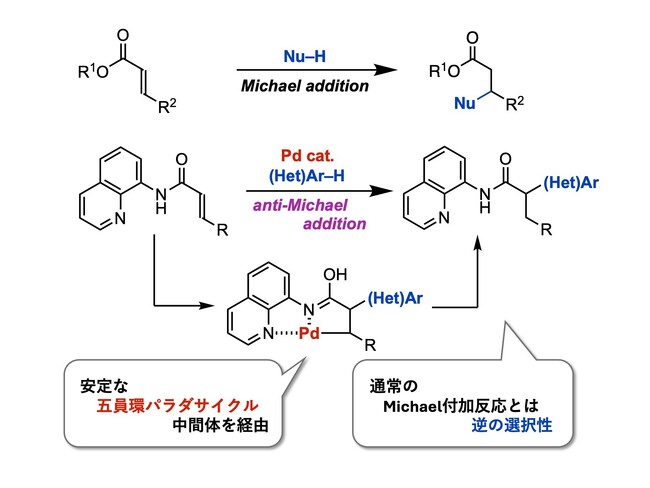 図 通常のMichael付加反応(上)と本研究において開発したanti-Michael型付加反応(下)
【研究の背景】
図 通常のMichael付加反応(上)と本研究において開発したanti-Michael型付加反応(下)
【研究の背景】
アクリルアミドのようなα,β-不飽和カルボニル化合物に対する、β位への求核付加反応であるMichael付加反応は古くより研究されています。一方でanti-Michael型付加反応、つまりα位への求核付加反応は非常に困難な課題とされています。その理由として、カルボニル基と共役したアルケン部位が活性化されており、電子不足なβ位炭素への求核付加が優先して起こることが挙げられます。そのため、β位に強い電子求引基をもつ基質や、分子内反応などの特殊な例を除いては、ほとんど報告例がありません。
今回本研究グループはα,β-不飽和カルボニル化合物への配向基の導入による、五員環パラダサイクル形成(*4)を介した反応中間体の安定化により、anti-Michael型付加反応を実現できると考えました。
【研究結果の詳細】
はじめに、8-アミノキノリル基を持つアクリルアミド、および求核剤として1-メチルインドールをモデル基質とし、パラジウム触媒存在下でのanti-Michael型付加反応について検討を行いました。その結果、Pd(OCOCF3)2(トリフルオロ酢酸パラジウム)存在下、アセトニトリル中でアクリルアミドと1-メチルインドールを反応させると、90%という高収率で選択的に目的物が得られました。2 mmolスケールで反応を行った際にも収率が低下することなく目的物が得られ、本反応の実用性が示されました。β位に芳香環を持つ桂皮酸アミド誘導体や、アルキル基を持つクロトンアミド誘導体を用いた場合にも対応する付加生成物が得られました。また、二置換インドールなど多くのインドール、ピロールやチオフェンなどの複素環化合物、電子豊富な芳香族化合物など広範な求核剤を用いた場合にも円滑に反応が進行しました。さらには本反応で用いたアミノキノリル配向基はカルボン酸や他のアミドなどに変換可能であり、本反応の有用性を示すことができました。
現在想定されている本反応の反応機構は以下の通りです。
1.アクリルアミドがPd(OCOCF3)2に配位することでアルケンが活性化
2.安定な五員環パラダサイクル中間体を形成するようにインドールが求核攻撃することによって、アルキルパラジウム種が生成
3.酸によってパラジウムが脱離しPd(OCOCF3)2が再生するとともに、目的のα-置換カルボニル化合物が生成
本研究グループは重水素標識実験を行うことにより、上記の反応機構によって反応が進行していることを示唆しています。
※本研究は、日本学術振興会(JSPS)の科研費(JP23K13743, JP21K05061)の助成を受けて実施したものです。
【用語】
*1 α-置換カルボニル化合物: カルボニル基(>C=O)に隣接する炭素上の水素が別の官能基で置換された化合物。
*2 anti-Michael付加型反応: α,β-不飽和カルボニル化合物におけるMichael付加反応では、β位炭素(カルボニル基の炭素から数えて2つ隣の炭素)への付加が優先的に起こる。一方anti-Michael付加型反応では、通常のMichael付加反応と逆の選択性であるα位炭素(カルボニル基の炭素から数えて1つ隣の炭素)への付加が優先的に進行する。
*3 α,β-不飽和カルボニル化合物: カルボニル基(>C=O)に隣接する炭素とさらにその隣の炭素間で二重結合を形成している化合物。
*4 五員環パラダサイクル: キレート化合物など環状構造の中に金属原子が含まれる化合物をメタラサイクルという。本研究で生成した反応中間体は五員環内にパラジウム原子を含んでいるため、五員環パラダサイクルと呼ばれる。
【論文情報】
雑誌名:Journal of the American Chemical Society
論文タイトル:Palladium-Catalyzed anti-Michael-Type (Hetero)arylation of Acrylamides
著者:Hirotsugu Suzuki, Ryota Moro, and Takanori Matsuda
DOI:10.1021/jacs.4c00841
URL:
https://doi.org/10.1021/jacs.4c00841
【発表者】
松田 学則 東京理科大学 理学部第一部 応用化学科 教授
鈴木 弘嗣 福井大学 基盤部門 テニュアトラック推進本部 工学系重点領域 助教
茂呂 諒太 東京理科大学大学院 理学研究科 化学専攻(2024年度 修士課程2年)
【研究に関する問い合わせ先】
東京理科大学 理学部第一部 応用化学科 教授
松田 学則(まつだ たかのり)
E-mail:mtd【@】rs.tus.ac.jp
福井大学 基盤部門 テニュアトラック推進本部 工学系重点領域 助教
鈴木 弘嗣(すずき ひろつぐ)
E-mail:h-suzuki【@】u-fukui.ac.jp
【報道・広報に関する問い合わせ先】
東京理科大学 経営企画部 広報課
TEL:03-5228-8107 FAX:03-3260-5823
E-mail:koho【@】admin.tus.ac.jp
福井大学 広報センター
TEL:0776-27-9733
Email:sskoho-k【@】ad.u-fukui.ac.jp
【@】は@にご変更ください。
企業プレスリリース詳細へPR TIMESトップへ
(2024/07/11 10:00)
- データ提供
-
本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMESまでご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
