iPS細胞由来レジデントメモリーT細胞で子宮頸がん治療
学校法人 順天堂
― 健常人由来 ゲノム編集技術で拒絶反応軽減 ―
順天堂大学大学院医学研究科 血液内科学の古川芳樹大学院生、石井翠助教、安藤美樹教授、細胞療法・輸血学の安藤純教授、産婦人科学の寺尾泰久教授、およびスタンフォード大学医学部幹細胞生物学・再生医療研究所の中内啓光教授らの共同研究グループは、健康な人から樹立したiPS細胞にゲノム編集を行うことで、そのiPS細胞から作製したヒトパピローマウイルス(*1)特異的細胞傷害性T細胞(CTL)(*2)が、患者の免疫細胞から拒絶されずに子宮頸がんを強力に抑制できることを明らかにしました。さらに、そのiPS細胞由来CTL(*3)が大量の組織レジデントメモリーT細胞(*4)を含むために高い細胞傷害活性を持つことを解明したことより、難治性子宮頸がんに対して、有望な新規治療法となりうる可能性を示しました。本成果は、来夏にも開始を予定している子宮頸がんを対象としたiPS細胞由来CTL療法の医師主導治験の基礎的データとなるものです。 本論文は、Cell系の学術雑誌「Cell Reports Medicine」のオンライン版で2023年12月12日付け(米国東部時間)で先行公開されました。
◆本研究成果のポイント
健常人由来iPS細胞をゲノム編集することで、同種免疫反応を軽減したCTLの作製に成功
そのiPS細胞由来CTLは豊富に組織レジデントメモリーT細胞を含むため、もとのCTLと比較して、より強力に子宮頸がんを抑制できることを発見
◆背景
子宮頸がんは、ヒトパピローマウイルス(HPV)感染が原因で発症します。先進国ではワクチンの普及により患者数、死亡率ともに減少している中、国内では増加傾向が続いており、年間1万人以上の患者が新たに子宮頸がんと診断され、約3,000人が死亡しています。国内では子宮頸がんワクチン接種率は依然15%以下と低迷しており、20-30歳代における子宮頸がん発症数増加は特に深刻な問題です。子宮頸がんはマザーキラーと呼ばれ、結婚、妊娠、子育て世代の若い女性の場合、その進行は極めて速く予後不良であるため、有効な新規治療法開発が必要です。研究グループは、2020年に子宮頸がんに対するiPSC由来HPV抗原特異的CTL(HPV-CTL)の開発に成功し、その持続的で強力な抗腫瘍効果を証明しました。しかし、抗がん剤治療中の子宮頸がん患者血液からのCTL作製は難しく、また時間がかかり、さらに作製には高額なコストがかかることが実用化に向けた課題でした。一方で、健常人のCTLから樹立した他家iPS細胞を用いると上記の問題は解決する一方で、患者免疫細胞からの同種免疫反応が起こり、抗腫瘍効果が減弱する問題が生じます。そのため、研究グループはこの問題を解決するために、CRISPR/Cas9技術(*5)を用い、HLA(*6)クラスIをゲノム編集した健常人由来他家HPV-CTLの開発を試みました。
◆内容
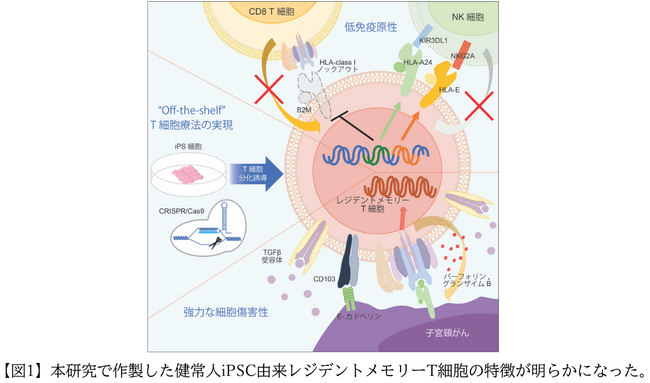
本研究では、はじめにHPV-CTLを健常人の末梢血より誘導後、iPS細胞を樹立しました。続いて、患者免疫細胞から攻撃されないようにするために、iPS細胞のHLAクラスI抗原を編集しました。ゲノム編集は、臨床で用いる細胞を作製するため安全面に配慮して、オフターゲット作用(*5)が少ないCRISPR/Cas9 二段階編集法を用いることにしました。まず、HLAクラスI分子の存在に重要なB2M遺伝子をノックアウトしてHLAクラスI抗原の発現を消失させることで、患者免疫T細胞から攻撃されないようにしました。しかしこれだけでは患者NK細胞(ナチュラル・キラー細胞)はHLAクラスI抗原の発現のない細胞を攻撃するため、次に攻撃を回避できるようにいくつかのクラスI分子を強制的に発現させました。NK細胞と抑制性の結合をすることで知られるHLA-EとHLA-A24の両分子を発現させることで、効果的にNK細胞の攻撃を抑制することができました。ゲノム編集したiPS細胞からCTLを分化誘導後、同種免疫反応を解析したところ、ゲノム編集したiPS細胞由来HPV-CTLはT細胞に拒絶されず、またNK細胞からの攻撃も回避できることを証明できました。さらに、ゲノム編集したことで子宮頸がんに対する抗腫瘍効果が軽減しないか確認しました。その結果、ゲノム編集したiPS細胞由来HPV-CTLは編集の有無に関わらず、強力に子宮頸がんの増殖を抑制できました。末梢血から誘導したもとのHPV-CTLよりも短期間で強力に抗腫瘍効果を発揮して、また長期間の生存期間延長効果も認めました。
そこで、なぜもともと同じT細胞受容体配列を持つCTLであるにも関わらず、このようにiPS細胞由来HPV-CTLでは細胞傷害活性が増強するのか、その機序を調べるためにシングルセル解析(*7)を行い、その遺伝子発現を比較しました。その結果、iPS細胞由来HPV-CTLは末梢血由来HPV-CTLに比較して細胞傷害活性に関する遺伝子(IFNG, PRF1, GZMB)および、組織レジデントメモリーT細胞に関係する遺伝子(ITGAE, CD69, TGFBR1)の発現レベルが有意に高いことがわかりました。フローサイトメトリーによる解析でも、iPS細胞由来HPV-CTLでは組織レジデントメモリーT細胞を豊富に含むことを示しました。機能解析の結果、iPS細胞由来HPV-CTLは TGFβシグナリング(*8)によりCD103発現レベルを有意に上昇させ、その結果HPV抗原特異的細胞傷害活性が増強することを証明しました。
以上より、本研究ではiPS細胞技術とゲノム編集技術を用いて、健常人由来iPS細胞から患者免疫細胞の攻撃を回避できるHPV-CTLの作製に成功し、作製したHPV-CTLは組織レジデントメモリーT細胞を豊富に含む結果、子宮頸がんに対して強力な細胞傷害活性をもたらすことを明らかにしました。同種免疫反応を軽減でき、かつT細胞の機能も強化された次世代T細胞療法の開発に成功したことにより、HPV-CTLは子宮頸がんに対する画期的な新規治療となりうることが示唆されました(図1)。
◆今後の展開
研究グループは、重症患者にも迅速に投与できる“off-the-shelf" T細胞療法(*9)を目指し、ゲノム編集した臨床用iPS細胞を作製しました。さらに安全性を十分に確認の後、この臨床用iPS細胞を増幅して凍結保存することで、マスターセルバンクを作製しました。今後、子宮頸がんに対する本治療の医師主導治験を開始する予定です。マザーキラーである子宮頸がんの克服に向けて重要な一歩となることが期待されます。
◆研究者のコメント
本研究では、ゲノム編集したiPS細胞由来HPV-CTLが免疫細胞の攻撃を回避可能であること、子宮頸がんに対する抗腫瘍効果を保持すること、そしてその強力な細胞傷害活性の機序を証明することができました。同時に順天堂大学細胞療法・輸血学のセルプロセッシングセンター内で、この方法で臨床用細胞の作製を進めています。
これらの結果より、次年度の医師主導治験の開始を目指しています。
研究グループは、マザーキラーである子宮頸がんの克服を目指し、着実に努力を続けます。
◆用語解説
*1 ヒトパピローマウイルス (Human papilloma virus: HPV): 子宮頸がんの原因ウイルス。HPV感染後、多くは自然にウイルスが排除されるが排除されなかった場合、前がん状態を経て子宮頸がんを発症する。
*2 抗原特異的細胞傷害性T細胞 (Antigen-specific cytotoxic T lymphocytes: CTL): 免疫細胞であるTリンパ球の中でも、ウイルス抗原や腫瘍抗原を認識し、異常細胞を攻撃するリンパ球。患者のウイルス特異的細胞傷害性T細胞を体外で増幅し、再び患者体内に戻すCTL療法は、重症ウイルス感染症やウイルス関連腫瘍に有効である。キラーT細胞とも呼ぶ。
*3 iPS細胞由来CTL: iPS細胞から作製した抗原特異的CTL。 iPS細胞技術は細胞の若返り法の一つと言える。この手法を利用して、HPV感染腫瘍に反応する末梢血中のHPV抗原特異性をもつCTLからiPS細胞を作製し、再びT細胞に分化させることにより、腫瘍を攻撃する若いCTLを無限に供給することが可能になる。
*4 メモリーT細胞: 抗原と出会う前のナイーブT細胞が抗原認識により活性化するとエフェクターT細胞となり、その一部が長期生存し次の抗原暴露に備えるため分化したT細胞。2回目の抗原暴露によりメモリーT細胞はすぐにエフェクターT細胞となり最初の抗原暴露に比較し早く効率よく反応する。
*5 CRISPR/Cas9技術とオフターゲット作用: 部位特異的ヌクレアーゼを使った簡便な遺伝子改変ツール。DNAの二本鎖切断を介して修復機構を利用することによりゲノムの特定の場所を削除、置換、挿入することが可能。しかしながら、通常の標的以外の場所で遺伝子切断が発生することがあり、それをオフターゲット作用と呼ぶ。
*6 HLA (Human Leukocyte Antigen): ヒト白血球抗原と言われる白血球型。免疫系で「自己」を「他者」と区別する役割を果たす。異なる個体でHLAが異なるため造血幹細胞移植や免疫細胞療法の際の免疫反応に重要な役割を果たす。
*7 シングルセル解析: 1つの細胞からRNA情報を取得し、個別の細胞の遺伝子発現パターンを詳細に調査する次世代シーケンシング解析。これにより、異なる細胞の個別の特性を理解でき、がんや免疫応答の微細な変化を把握するのに役立つ。
*8 TGFβシグナリング: TGFβとは細胞増殖・分化を制御し、細胞死を促すことが知られているサイトカイン。TGFβシグナルが、がん化を未然に防ぐと考えられている。
*9 “off-the-shelf" T細胞療法: 患者由来細胞ではなく, 健常人由来の他家iPSC由来T細胞を作製してバンキングすることによって,必要時にいつでも十分量の治療用T細胞が提供できる治療。
◆原著論文
本研究はCell Reports Medicine誌のオンライン版に2023年12月12日付(米国東部時間)で公開されました。
タイトル: iPSC-derived hypoimmunogenic tissue resident memory T cells mediate robust anti-tumor activity against cervical cancer
タイトル(日本語訳): iPS細胞由来レジデントメモリーT細胞の子宮頸がんに対する強力な抗腫瘍効果
著者:Yoshiki Furukawa1†, Midori Ishii1†, Jun Ando1,2, Kazuya Ikeda3, Kyomi J. Igarashi4, Shintaro Kinoshita1, Yoko Azusawa2, Tokuko Toyota1, Tadahiro Honda1, Mahito Nakanishi5, Koichi Ohshima6, Ayako Masuda7, Emiko Yoshida7, Mari Kitade7, Matthew Porteus3, Yasuhisa Terao7, Hiromitsu Nakauchi4*, Miki Ando1*
著者(日本語表記): 古川芳樹1)、石井翠1)、安藤純1),2)、池田和哉3)、Kyomi J. Igarashi4)、木下慎太郎1)、梓澤陽子2)、豊田釈子1)、本田匡宏1)、中西真人5)、大島孝一6)、増田彩子7)、吉田恵美子7)、北出真里7)、Matthew Porteus 3)、寺尾泰久7)、中内啓光4)、安藤美樹1)
著者所属:1)順天堂大学血液学講座、2)順天堂大学細胞療法・輸血学講座、3)スタンフォード大学小児科学講座、4)スタンフォード大学幹細胞生物学・再生医療研究所、5)ときわバイオ株式会社、6)久留米大学病理学講座、7)順天堂大学産婦人科学講座
DOI: https://doi.org/10.1016/j.xcrm.2023.101327
本研究はAMED (JP19bm0404032, JP19be0404011, and JP21bk0104117),およびJSPS科研費(18K07273)の支援を受け多施設との共同研究の基に実施されました。なお、本研究にご協力いただいた皆様に深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ
― 健常人由来 ゲノム編集技術で拒絶反応軽減 ―
順天堂大学大学院医学研究科 血液内科学の古川芳樹大学院生、石井翠助教、安藤美樹教授、細胞療法・輸血学の安藤純教授、産婦人科学の寺尾泰久教授、およびスタンフォード大学医学部幹細胞生物学・再生医療研究所の中内啓光教授らの共同研究グループは、健康な人から樹立したiPS細胞にゲノム編集を行うことで、そのiPS細胞から作製したヒトパピローマウイルス(*1)特異的細胞傷害性T細胞(CTL)(*2)が、患者の免疫細胞から拒絶されずに子宮頸がんを強力に抑制できることを明らかにしました。さらに、そのiPS細胞由来CTL(*3)が大量の組織レジデントメモリーT細胞(*4)を含むために高い細胞傷害活性を持つことを解明したことより、難治性子宮頸がんに対して、有望な新規治療法となりうる可能性を示しました。本成果は、来夏にも開始を予定している子宮頸がんを対象としたiPS細胞由来CTL療法の医師主導治験の基礎的データとなるものです。 本論文は、Cell系の学術雑誌「Cell Reports Medicine」のオンライン版で2023年12月12日付け(米国東部時間)で先行公開されました。
◆本研究成果のポイント
健常人由来iPS細胞をゲノム編集することで、同種免疫反応を軽減したCTLの作製に成功
そのiPS細胞由来CTLは豊富に組織レジデントメモリーT細胞を含むため、もとのCTLと比較して、より強力に子宮頸がんを抑制できることを発見
◆背景
子宮頸がんは、ヒトパピローマウイルス(HPV)感染が原因で発症します。先進国ではワクチンの普及により患者数、死亡率ともに減少している中、国内では増加傾向が続いており、年間1万人以上の患者が新たに子宮頸がんと診断され、約3,000人が死亡しています。国内では子宮頸がんワクチン接種率は依然15%以下と低迷しており、20-30歳代における子宮頸がん発症数増加は特に深刻な問題です。子宮頸がんはマザーキラーと呼ばれ、結婚、妊娠、子育て世代の若い女性の場合、その進行は極めて速く予後不良であるため、有効な新規治療法開発が必要です。研究グループは、2020年に子宮頸がんに対するiPSC由来HPV抗原特異的CTL(HPV-CTL)の開発に成功し、その持続的で強力な抗腫瘍効果を証明しました。しかし、抗がん剤治療中の子宮頸がん患者血液からのCTL作製は難しく、また時間がかかり、さらに作製には高額なコストがかかることが実用化に向けた課題でした。一方で、健常人のCTLから樹立した他家iPS細胞を用いると上記の問題は解決する一方で、患者免疫細胞からの同種免疫反応が起こり、抗腫瘍効果が減弱する問題が生じます。そのため、研究グループはこの問題を解決するために、CRISPR/Cas9技術(*5)を用い、HLA(*6)クラスIをゲノム編集した健常人由来他家HPV-CTLの開発を試みました。
◆内容
本研究では、はじめにHPV-CTLを健常人の末梢血より誘導後、iPS細胞を樹立しました。続いて、患者免疫細胞から攻撃されないようにするために、iPS細胞のHLAクラスI抗原を編集しました。ゲノム編集は、臨床で用いる細胞を作製するため安全面に配慮して、オフターゲット作用(*5)が少ないCRISPR/Cas9 二段階編集法を用いることにしました。まず、HLAクラスI分子の存在に重要なB2M遺伝子をノックアウトしてHLAクラスI抗原の発現を消失させることで、患者免疫T細胞から攻撃されないようにしました。しかしこれだけでは患者NK細胞(ナチュラル・キラー細胞)はHLAクラスI抗原の発現のない細胞を攻撃するため、次に攻撃を回避できるようにいくつかのクラスI分子を強制的に発現させました。NK細胞と抑制性の結合をすることで知られるHLA-EとHLA-A24の両分子を発現させることで、効果的にNK細胞の攻撃を抑制することができました。ゲノム編集したiPS細胞からCTLを分化誘導後、同種免疫反応を解析したところ、ゲノム編集したiPS細胞由来HPV-CTLはT細胞に拒絶されず、またNK細胞からの攻撃も回避できることを証明できました。さらに、ゲノム編集したことで子宮頸がんに対する抗腫瘍効果が軽減しないか確認しました。その結果、ゲノム編集したiPS細胞由来HPV-CTLは編集の有無に関わらず、強力に子宮頸がんの増殖を抑制できました。末梢血から誘導したもとのHPV-CTLよりも短期間で強力に抗腫瘍効果を発揮して、また長期間の生存期間延長効果も認めました。
そこで、なぜもともと同じT細胞受容体配列を持つCTLであるにも関わらず、このようにiPS細胞由来HPV-CTLでは細胞傷害活性が増強するのか、その機序を調べるためにシングルセル解析(*7)を行い、その遺伝子発現を比較しました。その結果、iPS細胞由来HPV-CTLは末梢血由来HPV-CTLに比較して細胞傷害活性に関する遺伝子(IFNG, PRF1, GZMB)および、組織レジデントメモリーT細胞に関係する遺伝子(ITGAE, CD69, TGFBR1)の発現レベルが有意に高いことがわかりました。フローサイトメトリーによる解析でも、iPS細胞由来HPV-CTLでは組織レジデントメモリーT細胞を豊富に含むことを示しました。機能解析の結果、iPS細胞由来HPV-CTLは TGFβシグナリング(*8)によりCD103発現レベルを有意に上昇させ、その結果HPV抗原特異的細胞傷害活性が増強することを証明しました。
以上より、本研究ではiPS細胞技術とゲノム編集技術を用いて、健常人由来iPS細胞から患者免疫細胞の攻撃を回避できるHPV-CTLの作製に成功し、作製したHPV-CTLは組織レジデントメモリーT細胞を豊富に含む結果、子宮頸がんに対して強力な細胞傷害活性をもたらすことを明らかにしました。同種免疫反応を軽減でき、かつT細胞の機能も強化された次世代T細胞療法の開発に成功したことにより、HPV-CTLは子宮頸がんに対する画期的な新規治療となりうることが示唆されました(図1)。

◆今後の展開
研究グループは、重症患者にも迅速に投与できる“off-the-shelf" T細胞療法(*9)を目指し、ゲノム編集した臨床用iPS細胞を作製しました。さらに安全性を十分に確認の後、この臨床用iPS細胞を増幅して凍結保存することで、マスターセルバンクを作製しました。今後、子宮頸がんに対する本治療の医師主導治験を開始する予定です。マザーキラーである子宮頸がんの克服に向けて重要な一歩となることが期待されます。
◆研究者のコメント
本研究では、ゲノム編集したiPS細胞由来HPV-CTLが免疫細胞の攻撃を回避可能であること、子宮頸がんに対する抗腫瘍効果を保持すること、そしてその強力な細胞傷害活性の機序を証明することができました。同時に順天堂大学細胞療法・輸血学のセルプロセッシングセンター内で、この方法で臨床用細胞の作製を進めています。
これらの結果より、次年度の医師主導治験の開始を目指しています。
研究グループは、マザーキラーである子宮頸がんの克服を目指し、着実に努力を続けます。
◆用語解説
*1 ヒトパピローマウイルス (Human papilloma virus: HPV): 子宮頸がんの原因ウイルス。HPV感染後、多くは自然にウイルスが排除されるが排除されなかった場合、前がん状態を経て子宮頸がんを発症する。
*2 抗原特異的細胞傷害性T細胞 (Antigen-specific cytotoxic T lymphocytes: CTL): 免疫細胞であるTリンパ球の中でも、ウイルス抗原や腫瘍抗原を認識し、異常細胞を攻撃するリンパ球。患者のウイルス特異的細胞傷害性T細胞を体外で増幅し、再び患者体内に戻すCTL療法は、重症ウイルス感染症やウイルス関連腫瘍に有効である。キラーT細胞とも呼ぶ。
*3 iPS細胞由来CTL: iPS細胞から作製した抗原特異的CTL。 iPS細胞技術は細胞の若返り法の一つと言える。この手法を利用して、HPV感染腫瘍に反応する末梢血中のHPV抗原特異性をもつCTLからiPS細胞を作製し、再びT細胞に分化させることにより、腫瘍を攻撃する若いCTLを無限に供給することが可能になる。
*4 メモリーT細胞: 抗原と出会う前のナイーブT細胞が抗原認識により活性化するとエフェクターT細胞となり、その一部が長期生存し次の抗原暴露に備えるため分化したT細胞。2回目の抗原暴露によりメモリーT細胞はすぐにエフェクターT細胞となり最初の抗原暴露に比較し早く効率よく反応する。
*5 CRISPR/Cas9技術とオフターゲット作用: 部位特異的ヌクレアーゼを使った簡便な遺伝子改変ツール。DNAの二本鎖切断を介して修復機構を利用することによりゲノムの特定の場所を削除、置換、挿入することが可能。しかしながら、通常の標的以外の場所で遺伝子切断が発生することがあり、それをオフターゲット作用と呼ぶ。
*6 HLA (Human Leukocyte Antigen): ヒト白血球抗原と言われる白血球型。免疫系で「自己」を「他者」と区別する役割を果たす。異なる個体でHLAが異なるため造血幹細胞移植や免疫細胞療法の際の免疫反応に重要な役割を果たす。
*7 シングルセル解析: 1つの細胞からRNA情報を取得し、個別の細胞の遺伝子発現パターンを詳細に調査する次世代シーケンシング解析。これにより、異なる細胞の個別の特性を理解でき、がんや免疫応答の微細な変化を把握するのに役立つ。
*8 TGFβシグナリング: TGFβとは細胞増殖・分化を制御し、細胞死を促すことが知られているサイトカイン。TGFβシグナルが、がん化を未然に防ぐと考えられている。
*9 “off-the-shelf" T細胞療法: 患者由来細胞ではなく, 健常人由来の他家iPSC由来T細胞を作製してバンキングすることによって,必要時にいつでも十分量の治療用T細胞が提供できる治療。
◆原著論文
本研究はCell Reports Medicine誌のオンライン版に2023年12月12日付(米国東部時間)で公開されました。
タイトル: iPSC-derived hypoimmunogenic tissue resident memory T cells mediate robust anti-tumor activity against cervical cancer
タイトル(日本語訳): iPS細胞由来レジデントメモリーT細胞の子宮頸がんに対する強力な抗腫瘍効果
著者:Yoshiki Furukawa1†, Midori Ishii1†, Jun Ando1,2, Kazuya Ikeda3, Kyomi J. Igarashi4, Shintaro Kinoshita1, Yoko Azusawa2, Tokuko Toyota1, Tadahiro Honda1, Mahito Nakanishi5, Koichi Ohshima6, Ayako Masuda7, Emiko Yoshida7, Mari Kitade7, Matthew Porteus3, Yasuhisa Terao7, Hiromitsu Nakauchi4*, Miki Ando1*
著者(日本語表記): 古川芳樹1)、石井翠1)、安藤純1),2)、池田和哉3)、Kyomi J. Igarashi4)、木下慎太郎1)、梓澤陽子2)、豊田釈子1)、本田匡宏1)、中西真人5)、大島孝一6)、増田彩子7)、吉田恵美子7)、北出真里7)、Matthew Porteus 3)、寺尾泰久7)、中内啓光4)、安藤美樹1)
著者所属:1)順天堂大学血液学講座、2)順天堂大学細胞療法・輸血学講座、3)スタンフォード大学小児科学講座、4)スタンフォード大学幹細胞生物学・再生医療研究所、5)ときわバイオ株式会社、6)久留米大学病理学講座、7)順天堂大学産婦人科学講座
DOI: https://doi.org/10.1016/j.xcrm.2023.101327
本研究はAMED (JP19bm0404032, JP19be0404011, and JP21bk0104117),およびJSPS科研費(18K07273)の支援を受け多施設との共同研究の基に実施されました。なお、本研究にご協力いただいた皆様に深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ
(2023/12/13 01:00)
- データ提供
-

本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMES ( )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
 )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
























