小細胞肺がんに対するiPS細胞由来GD2抗原標的CART療法の開発
学校法人 順天堂
― 小細胞肺がんに対する新たな治療法となる可能性 ―
小細胞肺がんは非常に転移しやすく、極めて難治性の肺がんです。順天堂大学医学部内科学教室・血液学講座の木下慎太郎助手、大学院医学研究科血液内科学 安藤美樹教授、細胞療法・輸血学の安藤純教授、呼吸器内科学の高橋和久教授、およびスタンフォード大学医学部幹細胞生物学・再生医療研究所の中内啓光教授らの共同研究グループは、抗原特異的細胞傷害性T細胞(CTL)(*1)をリプログラミングして作ったiPS細胞に小細胞肺がんに高発現するGD2抗原(*2)標的キメラ抗原受容体(GD2-CAR)(*3)を遺伝子導入後、分化誘導したiPS細胞由来GD2-CART細胞(*4)が、極めて難治性である小細胞肺がんに対して強力な細胞傷害活性を発揮できることを明らかにしました。さらに、シングルセル解析(*5)を用いて、iPS細胞由来GD2-CART細胞が末梢血由来のGD2-CART細胞と比較して、疲弊マーカーであるTIGIT(*6)の発現が非常に低いことを明らかにし、小細胞肺がんに対して強力な抗腫瘍効果を発揮できる機序を明らかにしました。
この成果により、固形がんの中でも難治性腫瘍である小細胞肺がんに対し、iPS細胞由来CART細胞を用いた新規治療法の開発の可能性が大きく広がりました。
本研究は米国癌学会雑誌であるCancer Research Communicationsに2024年2月21日付でオンライン版に公開されました。
本研究成果のポイント
極めて難治な小細胞肺がんに対する治療としてiPS細胞由来GD2-CART療法を開発した。
iPS細胞由来のGD2-CART細胞は小細胞肺がんに対して強力な抗腫瘍効果を発揮でき、その機序として疲弊マーカーのTIGITが低発現であることを明らかにした。
治療選択肢の限られる進展型小細胞肺がんに対する新たな治療の選択肢として期待。
背景
小細胞肺がんは、全ての肺がんの約15%を占めています。小細胞肺がんは非常に転移しやすく、患者の80~85%がより進んだ病期である進展型で診断されています。ほとんどの患者が初期の化学療法に反応しますが、通常6ヶ月以内に再発し、生存期間は約10~13ヶ月と予後不良です。また新規治療法の開発も遅れており、近年ようやく免疫チェックポイント阻害薬である抗PD-L1抗体が承認されましたが、それ以前は小細胞肺がんに対する新規治療開発は、30年以上にわたり進展がありませんでした。しかし抗PD-L1抗体の効果も一部の患者に限定的であるため、小細胞肺がんに対する治療戦略の開発は急務です。
本研究では、小細胞肺がん細胞株の約8割に糖鎖抗原GD2が高発現していることに着目しました。GD2抗原を標的とするキメラ抗原受容体T細胞(CART)療法は小細胞肺がんの有効な新規治療法になりうると考えましたが、末梢血GD2-CART細胞は、他のGD2陽性腫瘍に細胞傷害活性を示すにも関わらず、小細胞肺がんに対しては十分な細胞傷害活性を示しませんでした。研究グループはiPS細胞技術を用いることで、疲弊した抗原特異的CTLが強い増殖能を持ち、幼若なメモリーT細胞が増加することから機能的若返りを証明してきました。そのため、本研究では、iPS細胞技術を用いて作製したiPS細胞由来GD2-CART療法が難治性小細胞肺がんの有効な治療法になるか検討しました。
内容
レンチウイルス由来GD2-CARプラスミドを作製し、iPS細胞にGD2-CAR遺伝子を導入しました。その後、iPS細胞由来GD2-CART細胞への分化誘導を行い、CAR導入効率と抗原特異性をflow cytometryで確認しました。in vitroにおける小細胞肺がんに対する末梢血由来GD2-CART細胞とiPS細胞由来GD2-CART細胞の抗腫瘍効果を比較したところ、iPS細胞由来GD2-CART細胞は非常に強力な抗腫瘍効果を示しました。また免疫不全マウスを用いたin vivo実験においてもiPS細胞由来GD2-CART細胞は末梢血由来GD2-CART細胞よりも小細胞肺がんの腫瘍内に多く到達しており、強い腫瘍抑制効果を示すことを明らかにしました。
そこで、なぜiPS細胞由来GD2-CART細胞が末梢血由来GD2-CART細胞と比較して、小細胞肺がんに対する強力な抗腫瘍効果を有しているかを解明するためにシングルセル解析をおこないました。シングルセル解析では、1細胞毎の遺伝子発現と細胞表面抗原発現を網羅的に確認できます。iPS細胞由来GD2-CART細胞は末梢血由来GD2-CART細胞と比較して、細胞傷害活性に関する遺伝子 (PRF1, GZMB, IFNG)の発現レベルが高く、免疫シナプスの形成に関与する遺伝子(ITGAL, CD18, CD44, PTPRCなど)の発現レベルも高いことがわかりました。
さらに特徴的な事実として、iPS細胞由来GD2-CART細胞において、T細胞の疲弊マーカーであるTIGIT, PD-1, LAG3の発現レベルは明らかに低く(図1)、中でもTIGITは小細胞肺がんと共培養した後でも低発現を保っていました。

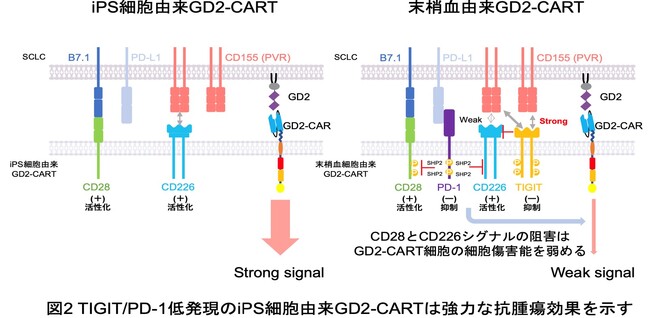
T細胞表面に発現するCD226は、腫瘍細胞表面に発現しているCD155と結合することでT細胞を活性化し、抗腫瘍効果を発揮します。しかし、TIGITはCD226と比較しCD155に対してより強力な結合能を持つため、TIGITを高発現する疲弊したT細胞は、CD226-CD155結合が上手にできず、抗腫瘍効果を発揮することが出来ません。そのため研究グループは、iPS細胞由来GD2-CART細胞ではTIGIT発現レベルが末梢血由来GD2-CART細胞に比較して有意に低いため、小細胞肺がんに対して高い抗腫瘍効果を発揮できるのではないかと考えました (図2)。
この仮説を証明するために、TIGITに対する抗体を用いてTIGITを阻害することで、小細胞肺がんに対して抗腫瘍効果を示さなかった末梢血由来GD2-CART細胞が、抗腫瘍効果を発揮できるか検討しましたが、TIGITを阻害するだけでは抗腫瘍効果を発揮することはできませんでした。PD-1もCD226-CD155シグナルを抑制することが報告されているため、末梢血由来GD2-CARTのPD-1とTIGITを同時に阻害したところ、小細胞肺がんに対して、ある程度の抗腫瘍効果が得られることを証明することができました。
以上より本研究では、iPS細胞由来GD2-CART細胞はT細胞の疲弊マーカーであるPD-1とTIGITの発現が低いため、小細胞肺がんに強力な細胞傷害活性を発揮できることを明らかにしました。これらの結果により、iPS細胞技術とCART療法の技術を用いることで難治性の小細胞肺がんに対する画期的な新規治療となりうることが示唆されました。
今後の展開
研究グループは、これまでに、健常人のCTL由来iPS細胞をセルプロセッシングセンター内で作製後、免疫拒絶を抑制するためのゲノム編集を行った臨床用iPS細胞のマスターセルバンクを作製しています。
今後、このマスターセルバンクのiPS細胞に臨床用GD2-CARウイルスベクターを作製後、遺伝子導入して分化誘導することで、臨床用iPS細胞由来GD2-CART細胞が作製できます。
これにより、必要時に迅速に投与できる“off-the-shelf" CART療法を目指します。
用語解説
*1抗原特異的細胞傷害性T細胞 (Antigen-specific cytotoxic T lymphocytes: CTL): 免疫細胞であるTリンパ球の中でも、ウイルス抗原や腫瘍抗原を認識し、異常細胞を攻撃するリンパ球。患者のウイルス特異的細胞傷害性T細胞を体外で増幅し、再び患者体内に戻すCTL療法は、重症ウイルス感染症やウイルス関連腫瘍に有効である。キラーT細胞とも呼ぶ。
*2 GD2抗原: 細胞表面に発現している糖鎖抗原。神経芽腫、悪性黒色腫、一部の肉腫や神経膠芽腫に発現しているがん抗原で、治療標的として有望な分子である。
*3キメラ抗原受容体 (CAR): 腫瘍細胞表面に発現する抗原に対して特異的なモノクローナル抗体の軽鎖と重鎖を直列に結合させた一本鎖抗体と、T細胞受容体のζ鎖を人工的に繋げたキメラ抗原受容体。
*4 iPS細胞由来GD2-CAR-T細胞: CTLから作成されたiPS細胞にGD2-CAR遺伝子を導入し、CTLに分化誘導した細胞。全ての細胞がGD2-CARを発現するため、強力な抗腫瘍効果を発揮する。
*5シングルセル解析: 1つの細胞からRNA情報を取得し、個別の細胞の遺伝子発現パターンを詳細に調査する次世代シーケンシング解析。これにより、異なる細胞の個別の特性を理解でき、がんや免疫応答の微細な変化を把握するのに役立つ。
*6 TIGIT (T-cell immunoreceptor with Ig and ITIM domains): TIGITはT細胞やNK細胞に発現している疲弊マーカー。腫瘍表面のCD155と強力に結合することで、T細胞やNK細胞の活性化分子CD226がCD155と結合できなくなり、その結果、T細胞の活性化が阻害される。
研究者のコメント
小細胞肺がんは固形がんの中でも極めて予後不良のがんであり、新規治療法の開発に難渋しています。今回我々が開発したiPS細胞由来のGD2-CART療法が小細胞肺がん患者にとって希望の光となれば幸いです。
原著論文
本研究はCancer Research Communicationsのオンライン版に2024年2月21日付で公開されました。
タイトル: Rejuvenated iPSC-derived GD2-directed CART cells harbor robust cytotoxicity against small cell lung cancer
タイトル(日本語訳): iPS細胞由来若返りGD2-CART細胞の小細胞肺がんに対する強力な細胞傷害能
著者: Shintaro Kinoshita1, Midori Ishii1, Jun Ando1,2, Takaharu Kimura3, Tomoyuki Yamaguchi4, Sakiko Harada1, Fumiyuki Takahashi5, Kazutaka Nakashima6, Yozo Nakazawa7, Satoshi Yamazaki3, Koichi Ohshima6, Kazuhisa Takahashi5, Hiromitsu Nakauchi8,9*, Miki Ando1*
著者(日本語表記): 木下慎太郎1, 石井翠1, 安藤純1,2, 木村 隆治3, 山口智之4, 原田早希子1, 高橋史行5, 中嶋一貴6, 中沢洋三7, 山崎聡3, 大島孝一6, 高橋和久5, 中内啓光8,9*, 安藤美樹1*
著者所属:1)順天堂大学血液学講座、2)順天堂大学細胞療法・輸血学講座、3) 筑波大学 医学医療系 幹細胞治療研究室、 4) 東京薬科大学生命科学部 生命医科学科 再生医科学研究室、 5) 順天堂大学呼吸内科6)久留米大学病理学講座、7) 信州大学医学部小児医学教室、8)スタンフォード大学幹細胞生物学・再生医療研究所
DOI: 10.1158/2767-9764.CRC-23-0259
本研究はJSPS科研費19K07781の支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様に深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ
― 小細胞肺がんに対する新たな治療法となる可能性 ―
小細胞肺がんは非常に転移しやすく、極めて難治性の肺がんです。順天堂大学医学部内科学教室・血液学講座の木下慎太郎助手、大学院医学研究科血液内科学 安藤美樹教授、細胞療法・輸血学の安藤純教授、呼吸器内科学の高橋和久教授、およびスタンフォード大学医学部幹細胞生物学・再生医療研究所の中内啓光教授らの共同研究グループは、抗原特異的細胞傷害性T細胞(CTL)(*1)をリプログラミングして作ったiPS細胞に小細胞肺がんに高発現するGD2抗原(*2)標的キメラ抗原受容体(GD2-CAR)(*3)を遺伝子導入後、分化誘導したiPS細胞由来GD2-CART細胞(*4)が、極めて難治性である小細胞肺がんに対して強力な細胞傷害活性を発揮できることを明らかにしました。さらに、シングルセル解析(*5)を用いて、iPS細胞由来GD2-CART細胞が末梢血由来のGD2-CART細胞と比較して、疲弊マーカーであるTIGIT(*6)の発現が非常に低いことを明らかにし、小細胞肺がんに対して強力な抗腫瘍効果を発揮できる機序を明らかにしました。
この成果により、固形がんの中でも難治性腫瘍である小細胞肺がんに対し、iPS細胞由来CART細胞を用いた新規治療法の開発の可能性が大きく広がりました。
本研究は米国癌学会雑誌であるCancer Research Communicationsに2024年2月21日付でオンライン版に公開されました。
本研究成果のポイント
極めて難治な小細胞肺がんに対する治療としてiPS細胞由来GD2-CART療法を開発した。
iPS細胞由来のGD2-CART細胞は小細胞肺がんに対して強力な抗腫瘍効果を発揮でき、その機序として疲弊マーカーのTIGITが低発現であることを明らかにした。
治療選択肢の限られる進展型小細胞肺がんに対する新たな治療の選択肢として期待。
背景
小細胞肺がんは、全ての肺がんの約15%を占めています。小細胞肺がんは非常に転移しやすく、患者の80~85%がより進んだ病期である進展型で診断されています。ほとんどの患者が初期の化学療法に反応しますが、通常6ヶ月以内に再発し、生存期間は約10~13ヶ月と予後不良です。また新規治療法の開発も遅れており、近年ようやく免疫チェックポイント阻害薬である抗PD-L1抗体が承認されましたが、それ以前は小細胞肺がんに対する新規治療開発は、30年以上にわたり進展がありませんでした。しかし抗PD-L1抗体の効果も一部の患者に限定的であるため、小細胞肺がんに対する治療戦略の開発は急務です。
本研究では、小細胞肺がん細胞株の約8割に糖鎖抗原GD2が高発現していることに着目しました。GD2抗原を標的とするキメラ抗原受容体T細胞(CART)療法は小細胞肺がんの有効な新規治療法になりうると考えましたが、末梢血GD2-CART細胞は、他のGD2陽性腫瘍に細胞傷害活性を示すにも関わらず、小細胞肺がんに対しては十分な細胞傷害活性を示しませんでした。研究グループはiPS細胞技術を用いることで、疲弊した抗原特異的CTLが強い増殖能を持ち、幼若なメモリーT細胞が増加することから機能的若返りを証明してきました。そのため、本研究では、iPS細胞技術を用いて作製したiPS細胞由来GD2-CART療法が難治性小細胞肺がんの有効な治療法になるか検討しました。
内容
レンチウイルス由来GD2-CARプラスミドを作製し、iPS細胞にGD2-CAR遺伝子を導入しました。その後、iPS細胞由来GD2-CART細胞への分化誘導を行い、CAR導入効率と抗原特異性をflow cytometryで確認しました。in vitroにおける小細胞肺がんに対する末梢血由来GD2-CART細胞とiPS細胞由来GD2-CART細胞の抗腫瘍効果を比較したところ、iPS細胞由来GD2-CART細胞は非常に強力な抗腫瘍効果を示しました。また免疫不全マウスを用いたin vivo実験においてもiPS細胞由来GD2-CART細胞は末梢血由来GD2-CART細胞よりも小細胞肺がんの腫瘍内に多く到達しており、強い腫瘍抑制効果を示すことを明らかにしました。
そこで、なぜiPS細胞由来GD2-CART細胞が末梢血由来GD2-CART細胞と比較して、小細胞肺がんに対する強力な抗腫瘍効果を有しているかを解明するためにシングルセル解析をおこないました。シングルセル解析では、1細胞毎の遺伝子発現と細胞表面抗原発現を網羅的に確認できます。iPS細胞由来GD2-CART細胞は末梢血由来GD2-CART細胞と比較して、細胞傷害活性に関する遺伝子 (PRF1, GZMB, IFNG)の発現レベルが高く、免疫シナプスの形成に関与する遺伝子(ITGAL, CD18, CD44, PTPRCなど)の発現レベルも高いことがわかりました。
さらに特徴的な事実として、iPS細胞由来GD2-CART細胞において、T細胞の疲弊マーカーであるTIGIT, PD-1, LAG3の発現レベルは明らかに低く(図1)、中でもTIGITは小細胞肺がんと共培養した後でも低発現を保っていました。

T細胞表面に発現するCD226は、腫瘍細胞表面に発現しているCD155と結合することでT細胞を活性化し、抗腫瘍効果を発揮します。しかし、TIGITはCD226と比較しCD155に対してより強力な結合能を持つため、TIGITを高発現する疲弊したT細胞は、CD226-CD155結合が上手にできず、抗腫瘍効果を発揮することが出来ません。そのため研究グループは、iPS細胞由来GD2-CART細胞ではTIGIT発現レベルが末梢血由来GD2-CART細胞に比較して有意に低いため、小細胞肺がんに対して高い抗腫瘍効果を発揮できるのではないかと考えました (図2)。

この仮説を証明するために、TIGITに対する抗体を用いてTIGITを阻害することで、小細胞肺がんに対して抗腫瘍効果を示さなかった末梢血由来GD2-CART細胞が、抗腫瘍効果を発揮できるか検討しましたが、TIGITを阻害するだけでは抗腫瘍効果を発揮することはできませんでした。PD-1もCD226-CD155シグナルを抑制することが報告されているため、末梢血由来GD2-CARTのPD-1とTIGITを同時に阻害したところ、小細胞肺がんに対して、ある程度の抗腫瘍効果が得られることを証明することができました。
以上より本研究では、iPS細胞由来GD2-CART細胞はT細胞の疲弊マーカーであるPD-1とTIGITの発現が低いため、小細胞肺がんに強力な細胞傷害活性を発揮できることを明らかにしました。これらの結果により、iPS細胞技術とCART療法の技術を用いることで難治性の小細胞肺がんに対する画期的な新規治療となりうることが示唆されました。
今後の展開
研究グループは、これまでに、健常人のCTL由来iPS細胞をセルプロセッシングセンター内で作製後、免疫拒絶を抑制するためのゲノム編集を行った臨床用iPS細胞のマスターセルバンクを作製しています。
今後、このマスターセルバンクのiPS細胞に臨床用GD2-CARウイルスベクターを作製後、遺伝子導入して分化誘導することで、臨床用iPS細胞由来GD2-CART細胞が作製できます。
これにより、必要時に迅速に投与できる“off-the-shelf" CART療法を目指します。
用語解説
*1抗原特異的細胞傷害性T細胞 (Antigen-specific cytotoxic T lymphocytes: CTL): 免疫細胞であるTリンパ球の中でも、ウイルス抗原や腫瘍抗原を認識し、異常細胞を攻撃するリンパ球。患者のウイルス特異的細胞傷害性T細胞を体外で増幅し、再び患者体内に戻すCTL療法は、重症ウイルス感染症やウイルス関連腫瘍に有効である。キラーT細胞とも呼ぶ。
*2 GD2抗原: 細胞表面に発現している糖鎖抗原。神経芽腫、悪性黒色腫、一部の肉腫や神経膠芽腫に発現しているがん抗原で、治療標的として有望な分子である。
*3キメラ抗原受容体 (CAR): 腫瘍細胞表面に発現する抗原に対して特異的なモノクローナル抗体の軽鎖と重鎖を直列に結合させた一本鎖抗体と、T細胞受容体のζ鎖を人工的に繋げたキメラ抗原受容体。
*4 iPS細胞由来GD2-CAR-T細胞: CTLから作成されたiPS細胞にGD2-CAR遺伝子を導入し、CTLに分化誘導した細胞。全ての細胞がGD2-CARを発現するため、強力な抗腫瘍効果を発揮する。
*5シングルセル解析: 1つの細胞からRNA情報を取得し、個別の細胞の遺伝子発現パターンを詳細に調査する次世代シーケンシング解析。これにより、異なる細胞の個別の特性を理解でき、がんや免疫応答の微細な変化を把握するのに役立つ。
*6 TIGIT (T-cell immunoreceptor with Ig and ITIM domains): TIGITはT細胞やNK細胞に発現している疲弊マーカー。腫瘍表面のCD155と強力に結合することで、T細胞やNK細胞の活性化分子CD226がCD155と結合できなくなり、その結果、T細胞の活性化が阻害される。
研究者のコメント
小細胞肺がんは固形がんの中でも極めて予後不良のがんであり、新規治療法の開発に難渋しています。今回我々が開発したiPS細胞由来のGD2-CART療法が小細胞肺がん患者にとって希望の光となれば幸いです。
原著論文
本研究はCancer Research Communicationsのオンライン版に2024年2月21日付で公開されました。
タイトル: Rejuvenated iPSC-derived GD2-directed CART cells harbor robust cytotoxicity against small cell lung cancer
タイトル(日本語訳): iPS細胞由来若返りGD2-CART細胞の小細胞肺がんに対する強力な細胞傷害能
著者: Shintaro Kinoshita1, Midori Ishii1, Jun Ando1,2, Takaharu Kimura3, Tomoyuki Yamaguchi4, Sakiko Harada1, Fumiyuki Takahashi5, Kazutaka Nakashima6, Yozo Nakazawa7, Satoshi Yamazaki3, Koichi Ohshima6, Kazuhisa Takahashi5, Hiromitsu Nakauchi8,9*, Miki Ando1*
著者(日本語表記): 木下慎太郎1, 石井翠1, 安藤純1,2, 木村 隆治3, 山口智之4, 原田早希子1, 高橋史行5, 中嶋一貴6, 中沢洋三7, 山崎聡3, 大島孝一6, 高橋和久5, 中内啓光8,9*, 安藤美樹1*
著者所属:1)順天堂大学血液学講座、2)順天堂大学細胞療法・輸血学講座、3) 筑波大学 医学医療系 幹細胞治療研究室、 4) 東京薬科大学生命科学部 生命医科学科 再生医科学研究室、 5) 順天堂大学呼吸内科6)久留米大学病理学講座、7) 信州大学医学部小児医学教室、8)スタンフォード大学幹細胞生物学・再生医療研究所
DOI: 10.1158/2767-9764.CRC-23-0259
本研究はJSPS科研費19K07781の支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様に深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ
(2024/02/28 14:00)
- データ提供
-

本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMES ( )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
 )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
























