順天堂大学発「子宮頸がんに対するiPS細胞由来CTL療法の医師主導治験」開始のお知らせ
学校法人 順天堂
~ウイルス抗原特異的次世代T細胞療法のFirst-in-human試験~
ポイント
・iPS細胞由来抗原特異的細胞傷害性T細胞(CTL)療法の安全性評価を目的とした医師主導第I相治験を開始
・使用するCTLは、iPS細胞技術および遺伝子編集技術を用いて、健常人由来細胞から作製
・ヒト・パピローマウイルス(HPV)感染細胞を標的としたCTL療法
・HLA-A*2402を持ったHPV16型陽性の子宮頸がん患者を対象
概要
順天堂大学大学院医学研究科 血液内科学 安藤美樹教授、細胞療法・輸血学 安藤純教授、産婦人科学 寺尾泰久教授、東京科学大学 中内啓光教授らの研究グループは、2018年から日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム、2021年から再生医療実用化研究事業の支援を受け、iPS細胞技術および遺伝子編集技術を用いて作製された健常人由来細胞を用いる他家CTL療法の研究開発を進めてきました。このたび、AMED再生医療等実用化研究事業において、HPV16型陽性の子宮頸がん患者を対象に、HPV16抗原を標的とした他家HPV特異的CTL療法の安全性評価を目的とした医師主導第I相治験を順天堂大学医学部附属順天堂医院で開始します。
背景
対象疾患について
子宮頸がんは、主にHPV感染が原因で発生するがんであり、女性の主要ながんの一つです。子宮頸がんワクチンは感染予防には有効ですが、できてしまったがんには有効ではありません。現在の標準治療法には、外科手術、放射線療法、化学療法およびこれらの組み合わせがあります。しかし、進行がんや再発がんの場合、これらの治療法が有効でないことが多く、予後不良であることが大きな問題であり、有効性の高い治療方法の開発が切望されています。
iPS細胞由来細胞傷害性T細胞について
抗原特異的CTLは、我々の体内にある抗原を攻撃するT細胞(キラーT細胞)ですが、がん患者の体内ではごく少数であり、さらにがん患者の体内で常に抗原に暴露されるため、疲弊して治療に使用する十分量の細胞数を得ることができません。そこで研究チームは、iPS細胞技術と遺伝子編集技術の両方の技術を用いることで、CTLを増幅・強化し、より多くの人に、すぐに使えるCTLを作製し、HPV16陽性子宮頸がんの治療を目指します(図1)。この治療法は、既存の治療法にはない新しい治療を提供する可能性があります。

図1 本治験の免疫細胞療法の概念図
医師主導治験概要 *1
2024年11月14日付けで、「子宮頸がんに対するiPSC由来CTL療法 医師主導治験第I相臨床試験」の治験届が受理され、2025年1月より順天堂大学医学部附属順天堂医院 産婦人科において医師主導治験を開始します。本治験は、HPV16型陽性子宮頸がん患者で再発後に既存の治療による効果が見込めない患者を対象とし、本剤(rejT-H01)の安全性を非盲検非対照試験で検討します。スケジュールは、本品投与の2日前までシクロホスファミド水和物500 mg/m2及びフルダラビンリン酸エステル30 mg/m2によるリンパ球除去療法を1日1回3日間点滴静注する。リンパ球除去療法の翌々日を0日目としrejT-H01を投与します。コホート0は単回投与とし、Day21までの安全性を確認後、コホート1~3の反復投与に移行します。反復投与ではrejT-H01を3週間に1回の間隔で投与します(図2)。
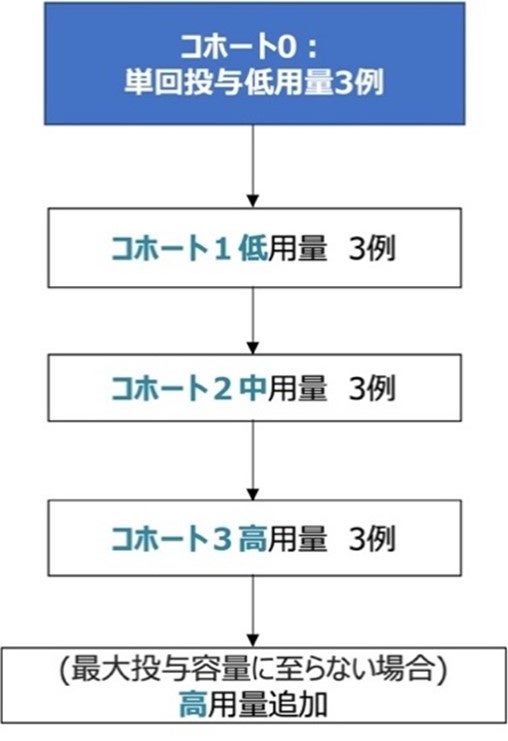
図2 本治験におけるコホート概略図
今後の展開
本治験は、HPV16型陽性子宮頸がん患者で再発後に既存の治療による効果が見込めない患者を対象としており、本治験で安全性を証明し、今後の第II-III相試験で有効性が証明できれば、これまで有効な手立てのなかった再発・難治性子宮頸がん患者に対して、新たな治療法となる可能性があります。
用語解説
*1 医師主導治験
治験のうち、製薬企業が主体となって行う治験と、治験を行う医師が自ら計画を立て行う治験があり、後者を「医師主導治験」といいます。治験は治療の効果と副作用が確認される前に実施されますので、通常の治療と異なり、研究的な側面が伴います。医師主導治験も企業治験と同様の基準の下で行われ、参加される患者の安全や倫理面に十分配慮して行われます。
企業プレスリリース詳細へ
PR TIMESトップへ
~ウイルス抗原特異的次世代T細胞療法のFirst-in-human試験~
ポイント
・iPS細胞由来抗原特異的細胞傷害性T細胞(CTL)療法の安全性評価を目的とした医師主導第I相治験を開始
・使用するCTLは、iPS細胞技術および遺伝子編集技術を用いて、健常人由来細胞から作製
・ヒト・パピローマウイルス(HPV)感染細胞を標的としたCTL療法
・HLA-A*2402を持ったHPV16型陽性の子宮頸がん患者を対象
概要
順天堂大学大学院医学研究科 血液内科学 安藤美樹教授、細胞療法・輸血学 安藤純教授、産婦人科学 寺尾泰久教授、東京科学大学 中内啓光教授らの研究グループは、2018年から日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム、2021年から再生医療実用化研究事業の支援を受け、iPS細胞技術および遺伝子編集技術を用いて作製された健常人由来細胞を用いる他家CTL療法の研究開発を進めてきました。このたび、AMED再生医療等実用化研究事業において、HPV16型陽性の子宮頸がん患者を対象に、HPV16抗原を標的とした他家HPV特異的CTL療法の安全性評価を目的とした医師主導第I相治験を順天堂大学医学部附属順天堂医院で開始します。
背景
対象疾患について
子宮頸がんは、主にHPV感染が原因で発生するがんであり、女性の主要ながんの一つです。子宮頸がんワクチンは感染予防には有効ですが、できてしまったがんには有効ではありません。現在の標準治療法には、外科手術、放射線療法、化学療法およびこれらの組み合わせがあります。しかし、進行がんや再発がんの場合、これらの治療法が有効でないことが多く、予後不良であることが大きな問題であり、有効性の高い治療方法の開発が切望されています。
iPS細胞由来細胞傷害性T細胞について
抗原特異的CTLは、我々の体内にある抗原を攻撃するT細胞(キラーT細胞)ですが、がん患者の体内ではごく少数であり、さらにがん患者の体内で常に抗原に暴露されるため、疲弊して治療に使用する十分量の細胞数を得ることができません。そこで研究チームは、iPS細胞技術と遺伝子編集技術の両方の技術を用いることで、CTLを増幅・強化し、より多くの人に、すぐに使えるCTLを作製し、HPV16陽性子宮頸がんの治療を目指します(図1)。この治療法は、既存の治療法にはない新しい治療を提供する可能性があります。

図1 本治験の免疫細胞療法の概念図
医師主導治験概要 *1
2024年11月14日付けで、「子宮頸がんに対するiPSC由来CTL療法 医師主導治験第I相臨床試験」の治験届が受理され、2025年1月より順天堂大学医学部附属順天堂医院 産婦人科において医師主導治験を開始します。本治験は、HPV16型陽性子宮頸がん患者で再発後に既存の治療による効果が見込めない患者を対象とし、本剤(rejT-H01)の安全性を非盲検非対照試験で検討します。スケジュールは、本品投与の2日前までシクロホスファミド水和物500 mg/m2及びフルダラビンリン酸エステル30 mg/m2によるリンパ球除去療法を1日1回3日間点滴静注する。リンパ球除去療法の翌々日を0日目としrejT-H01を投与します。コホート0は単回投与とし、Day21までの安全性を確認後、コホート1~3の反復投与に移行します。反復投与ではrejT-H01を3週間に1回の間隔で投与します(図2)。

図2 本治験におけるコホート概略図
今後の展開
本治験は、HPV16型陽性子宮頸がん患者で再発後に既存の治療による効果が見込めない患者を対象としており、本治験で安全性を証明し、今後の第II-III相試験で有効性が証明できれば、これまで有効な手立てのなかった再発・難治性子宮頸がん患者に対して、新たな治療法となる可能性があります。
用語解説
*1 医師主導治験
治験のうち、製薬企業が主体となって行う治験と、治験を行う医師が自ら計画を立て行う治験があり、後者を「医師主導治験」といいます。治験は治療の効果と副作用が確認される前に実施されますので、通常の治療と異なり、研究的な側面が伴います。医師主導治験も企業治験と同様の基準の下で行われ、参加される患者の安全や倫理面に十分配慮して行われます。
企業プレスリリース詳細へ
PR TIMESトップへ
(2025/01/06 16:33)
- データ提供
-

本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMES ( )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
 )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
























