再生医療の安全性を確保するために制定された再生医療等の安全性の確保等に関する法律(再生医療法)では、治療実施者に対し有害事象に関する報告義務を定めている。国立がん研究センター生命倫理部部長の一家綱邦氏、静岡社会健康医学大学院大学講師の八田太一氏らは、同法の現在までの施行状況および今後の改正の方向性を検討するため、京都大学と共同で有害事象の報告状況を調査。自由診療で行われる再生医療において、有害事象が適切に報告・検討されておらず、過少報告である可能性を見いだし、Stem Cell Rep(2023年11月3日オンライン版)に発表した。
自由診療と保険診療で報告対象に大差なし
再生医療法では、自由診療として行われる再生医療について提供機関の管理者に対し、再生医療等提供計画に記載された再生医療に起因するものと疑われる①死亡、②死亡につながる恐れのある症例、③治療のために病院または診療所への入院または入院期間の延長が必要とされる症例、④障害、⑤障害につながるおそれのある症例、⑥重篤である症例、⑦後世代における先天性の疾病または異常-の7種類について報告を義務付けている。さらに、これら以外の疾病や感染症などが発生した場合は、厚生労働省ではなく認定再生医療等委員会にのみ報告される。
それに対し、保険診療として行われる再生医療等製品を用いた治療に対しては、①死亡、②障害、③死亡または障害につながる恐れのある症例、④治療のために病院または診療所への入院または入院期間の延長が必要とされる症例、⑤死亡または②~④に準じて重篤である症例、⑥後世代における先天性の疾病または異常-の6種類について報告を義務付けている。さらに、再生医療等製品の不具合により①~⑥が発生する恐れがあるものも対象となるが、自由診療と保険診療において報告対象に大きな差異はない。
一家氏らは今回、自由診療での再生医療の安全性の確保を検証するため、厚労省が公表している全ての計画ベースの報告数と認定再生医療等委員会の議事録を突合し、有害事象の報告数を対比させた。
保険診療の3件に1件に対し、自由診療では1万件に1件
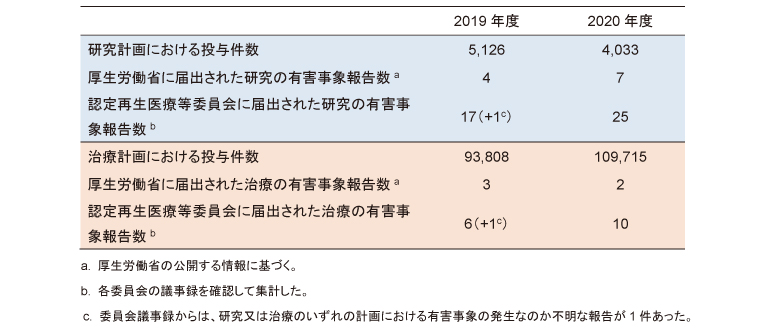
検討の結果、2019年度の再生医療(細胞)の投与件数は研究計画の5,126件に対し、治療計画は9万3,808件と18倍以上であるにもかかわらず、有害事象の報告数は治療計画の方が少なかった(17件 vs. 6件)。2020年度も同様の結果であり、報告制度が適切に機能しているかについて疑義が生じた(投与件数:4,033件 vs. 10万9,715件、報告数:25件 vs. 10件、表1)
表1.再生医療法に基づく再生医療(細胞)の投与件数と有害事象の発生報告数
一家氏らはこの疑義を検証するため、保険診療として行われる再生医療等製品3種類(ヒト表皮由来細胞シート「ジェイス」、ヒト自家培養軟骨「ジャック」、ヒト骨髄由来間葉系幹細胞「テムセルHS」)について使用回数と有害事象報告数を調査した。
医薬品医療機器総合機構(PMDA)が公表している「不具合が疑われる症例報告」から、3製品について「患者等の健康被害状況」に記載があるものを抽出したところ、2019年度の有害事象報告数は使用回数451件に対し125件(3.6件に1件)、2020年度は339件に対し129件(2.6件に1件)と、自由診療に比べて高頻度だった(表2)。これらの結果から、再生医療法下における報告数は不適切であることが示唆された。
表2.薬機法に基づく再生医療等製品の使用回数と有害事象の報告数

(表1、2とも国立がん研究センタープレスリリースより)
以上を踏まえ、同氏らは「自由診療において、有害事象の発生が再生医療法に基づいて適切に報告・検討されていない可能性がある。報告数に保険診療と大差が見られた原因は、関係者の"医療における安全性の確保"に対する意識の違いの表れと考えられる」と結論。「再生医療法の改正に際しては、患者からの報告を含む有害事象報告システムの見直しを検討すべきである」と提言した。
(服部美咲)






















