インスメッド(R)、2024年第4四半期業績、ならびにビジネスアップデート発表
インスメッド合同会社
この資料は、インスメッド(米国 ニュージャージー州)が2025年2月20日(現地時間)に発表した内容を日本語に翻訳(要約)したもので、参考資料として提供するものです。資料の内容および解釈については、米国における規制等に基づくもの及び英語による記載が優先されます。英語版および関連財務表は、https://insmed.com をご参照下さい。
- アリケイス(R)(アミカシンリポソーム吸入用懸濁液)*の第4四半期の売上高は1億440万ドル、2024年通年では3億6,370万ドルで、年間成長率19%を反映し、2024年通年のガイダンスレンジの上限を超過。
- 2025年のグローバルでのアリケイスの売上予想レンジを4億500万ドルから4億2,500万ドルとし、2024年に比べて二桁の成長を反映。
- 気管支拡張症患者を対象としたブレンソカチブの新薬承認申請(NDA)が米国食品医薬品局(FDA)によって受理され、優先審査の指定を受けた。処方薬ユーザー・フィー法(PDUFA)の目標終了期日は2025年8月12日。
- 肺動脈性肺高血圧症(PAH)患者を対象としたTPIPの第IIb相試験、鼻茸を伴わない慢性副鼻腔炎(CRSsNP)患者を対象としたブレンソカチブの第IIb試験(BiRCh試験)、アリケイスの第III相ENCORE試験は、それぞれ2025年半ば、2025年末、2026年第1四半期にトップラインデータが得られる見込み。
- 2024年末時点で約14億ドルの現金、現金同等物、および市場性のある有価証券を保有。
*日本ではアリケイス吸入液590mg(アミカシン硫酸塩 吸入用製剤)として承認されています。
2025年2月20日、米国ニュージャージー州発 人を第一に考え、深刻な疾患と生きる患者さんの未来を変える、ファースト・イン・クラスおよびベスト・イン・クラスの治療法の実現を目指すグローバルバイオ医薬品企業のインスメッド(Nasdaq: INSM)は、2024年12月31日に終了した第4四半期の業績、ビジネスアップデートを発表しました。
インスメッド会長兼最高経営責任者(CEO)のウィル・ルイスは、「インスメッドの歴史の中で最も重要な年を振り返るにあたり、当社は業界の中でも稀有な立場にあり、今後これまでにない機会が待ち受けていると感じています。2024年は、すべての事業領域における成功、特に気管支拡張症を対象としたブレンソカチブの画期的な第III相ASPEN試験の良好なデータの発表により、重篤な疾患に苦しむ多くの患者さんに治療を届ける可能性が開かれ、企業価値の大幅な向上につながりました。」と述べた上で、「2025年には、FDAの承認を前提に、ブレンソカチブの米国上市に向けた取り組みを進めてまいります。また、FDAから優先審査の指定を受け、NDAを受理されたことで、その目標に一歩近づいたことを大変嬉しく思います。並行して、充実した中期から後期開発パイプラインを引き続き推進し、アリケイスのグローバルでの二桁成長を見込んでいます。インスメッドの強固な財務基盤と独自の企業文化が、支援を必要とする患者さんのために成果を届ける力となると確信しています。」と述べています。
最近の主なハイライト
アリケイス
- アリケイスの2024年の売上高は、2023年に比べて19%増加し、米国、日本、欧州での強力な成長を反映しています。
- 2024年第4四半期に、新たに診断されたか再発したマイコバクテリウム・アビウムコンプレックス(MAC)肺疾患で抗生物質による治療を受けていない患者を対象とした第III相ENCORE試験の登録を完了しました。試験の登録総数は425名です。
- 2026年第1四半期にENCORE試験のトップラインデータの公表を見込んでおり、2026年後半には米国におけるすべての肺MAC症患者を対象にアリケイスのFDAへの適応追加申請(sNDA)を予定しています。
ブレンソカチブ
- 2025年2月、FDAはインスメッドによる気管支拡張症患者を対象としたブレンソカチブの新薬承認申請(NDA)を受領し、優先審査の申請を許可しました。処方薬ユーザー・フィー法(PDUFA)の目標終了期日は2025年8月12日です。薬事承認が得られた場合、引き続き、第3四半期の米国での上市を目指します。
- 欧州、英国および日本でのブレンソカチブの薬事申請は2025年を予定しており、各地域での承認を待って、2026年の上市を予定しています。
- 鼻茸を伴わない慢性副鼻腔炎(CRSnNP)患者を対象としたブレンソカチブの第IIb相試験(BiRCh試験)は、2025年末までにはトップラインデータ結果の公表を予定しています。
- 化膿性汗腺炎(HS)患者を対象としたブレンソカチブの第IIb相試験(CEDAR試験)において投与を開始しました。
TPIP
- 2025年2月1日にPulmonary Vascular Research Instituteの2025年年次世界学術会議において、間質性肺疾患に伴う肺高血圧症(PH-ILD)を対象としたTreprostinil Palmitil Inhalation Powder(TPIP)の第IIa相試験から得られた追加の肺画像データを発表しました。
- TPIPによる治療は、小動脈における血液量の割合を有意に増加させ、プラセボ群と比較して小動脈と大動脈の体積比の改善傾向を示し、小血管の血管拡張および肺細動脈の血流再分布の改善が示唆されました。
- さらに、TPIPで治療を受けた患者において、高吸収異常スコアに数値的な減少が認められました。
- 2025年後半に、間質性肺疾患に伴う肺高血圧症(PH-ILD)患者を対象としたTPIPの第III相試験を開始する予定です。
- TPIPの肺動脈性肺高血圧症(PAH)を対象とした第IIb相試験の登録は2024年12月に完了し、102名の患者に無作為割付けを実施しました。ブレンソカチブの米国上市に先立ち、2025年中頃にこの試験のトップラインデータを公表する予定です。
遺伝子治療
- デュシェンヌ型筋ジストロフィー(DMD)患者を対象とした髄腔内投与遺伝子治療薬INS1201の治験薬申請(IND)において、2024年12月にFDAから許可を取得しました。
- 2025年前半にINS1201の臨床試験を開始する予定です。
- 筋萎縮性側索硬化症(ALS)とスターガルト病を対象とする2つの遺伝子治療候補薬は、現在、治験に向けて準備が進められています。
前臨床プログラム
- 研究開発では、現在開発中の30以上の前臨床プログラムが含まれており、すべてが対象としている適応症に対し、ファースト・イン・クラス、あるいはベスト・イン・クラスの治療法になる可能性があります。
- 前臨床研究プログラムから、年間平均1~2件のIND申請を行う予定です。
- 前臨床研究プログラム全体に対する支出は年間支出全体の20%未満になると予想しています。
2024年第4四半期および通期の業績について
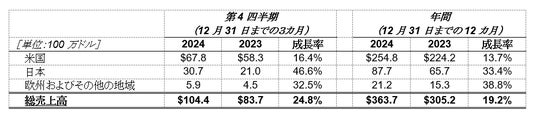
- 以下の表は、米国、日本、欧州およびその他の地域におけるアリケイスの2024年と2023年の第4四半期および年間売上高と売上成長率をまとめたものです。
- 売上原価(無形資産償却費を除く)は、2024年第4四半期に2,620万ドル、2023年第4四半期は1,840万ドルでした。2024年通年の売上原価(無形資産償却費を除く)は8,570万ドルで、2023年通年では6,560万ドルでした。第4四半期および通年における売上原価の増加は、主にアリケイスの売上高の伸びを反映したものです。
- 研究開発(R&D)費用は、2024年第4四半期に1億7,970万ドル、2023年第4四半期は1億3,700万ドルでした。2024年通年のR&D費用は5億9,840万ドルで、2023年通年は5億7,100万ドルでした。第4四半期および通年におけるR&D費用の増加は、主に人員増に伴う報酬および福利厚生関連費用の増加に加え、株式報酬費用の増加によるものです。
- 2024年第4四半期の販売および一般管理費(SG&A)は2023年第4四半期の8,950万ドルに対し1億4,250万ドルでした。2024年通年のSG&A費用は2023年通年の3億4,450万ドルに対し4億6,110万ドルでした。第4四半期および通年におけるSG&A費用の増加は、米国でのブレンソカチブの規制当局承認を前提とした発売準備に伴う人員増加により、報酬および福利厚生関連費用、および株式報酬費用が増加したことによるものです。
- 2024年第4四半期において、インスメッドは純損失として2億3,550万ドル(1株あたり1.32ドル)を報告しました。2023年第4四半期の純損失は1億8,610万ドル(1株あたり1.28ドル)でした。2024年通年において、インスメッドは純損失として9億1,380万ドル(1株あたり5.57ドル)を報告しました。2023年通年の純損失は7億4,960万ドル(1株あたり5.34ドル)でした。
貸借対照表、財政ガイダンス、計画投資について
- 2024年12月31日現在、インスメッドは、合計で約14億ドルの現金、現金同等物、および市場性のある有価証券を保有しています。
- 2025年通年のアリケイスの全世界での売上は2024年と比較して11~17%の年間成長をするという方向性を反映した4億500万~4億2,500万ドルと予測しています。
- 弊社は2025年には以下の主要な活動への投資を計画しています。
(i) 「アリケイス」のグローバルでのさらなる拡大。
(ii) ブレンソカチブについて、米国においては承認取得後の上市、EU、英国及び日本においては薬事申請の準備。
(iii) ブレンソカチブの臨床試験の推進。CRSsNP患者を対象とした第IIb試験(BiRCh試験)およびHS患者を対象としたIIb相試験(CEDAR試験)を含みます。
(iv) アリケイスの臨床試験の推進。現在の適応症の完全承認のためのFDAからの市販後要件を満たすことを目指し、可能性として肺MAC症の全患者への適応拡大を含みます。
(v) TPIPの臨床開発プログラムの推進。PAH患者を対象とした第IIb相試験の推進とPH-ILD患者を対象とした第III相試験の開始を含みます。
(vi) DMDを対象としたINS1201の臨床試験の推進。
(vii) 前臨床研究プログラムの継続的開発。
カンファレンスコール
インスメッドは、2025年2月20日午前8時(米国東部時間)よりカンファレンスコールを実施しました。この会議のウェブキャストは、当社ウェブサイト (www.insmed.com) の投資家情報セクションに90日間保存されます。
アリケイスについて
アリケイスは、米国ではARIKAYCE(R)(Amikacin Liposomal Inhalation Suspension/ALIS, アミカシンリポソーム吸入用懸濁液)、欧州ではARIKAYCE(R) Liposomal 590mg Nebuliser Dispersion、日本ではアリケイス吸入液590mg(アミカシン硫酸塩 吸入用製剤)として承認されています。現在、国際的な治療ガイドラインでは、適切な患者にアリケイスを使用することが推奨されています。アリケイスは、これまで静脈内投与されていたアミカシンを、1日1回、吸入投与する新規製剤です。当社独自のPULMOVANCE(R)リポソーム技術により、アミカシンを肺に直接到達させることで、従来懸念されていた聴覚、平衡感覚、および腎機能といった全身性の副作用の発現を抑えながら、主要な感染細胞である肺マクロファージに取り込まれることを可能としました。アリケイスは、PARI(R) Pharma GmbH(以下、PARI社)社製のラミラ(R) ネブライザシステムを使用して1日1回投与されます。
PARI社とラミラネブライザシステムについて
アリケイスは、PARI社が開発した新しい吸入器であるラミラネブライザシステムによって投与されます。ラミラは、振動する多孔質膜を介してアリケイスを効率的に噴霧することができる、静かで持ち運び可能なネブライザです。PARI社は、エアロゾルに関する100年の知見に基づき、患者の治療を向上させるための革新的な送達プラットフォームの開発を通じて、吸入治療の進歩に貢献しています。
ブレンソカチブについて
ブレンソカチブは、インスメッドが気管支拡張症やその他の好中球介在性疾患の治療薬として開発している低分子の経口ジペプチジルペプチダーゼ1(DPP1)可逆的阻害剤です。DPP1は、好中球が骨髄で形成される際に、好中球エラスターゼなどの好中球セリンプロテアーゼ(NSP)を活性化する酵素です。好中球は白血球の中で最も多く存在し、病原体の破壊や炎症性媒介において不可欠な役割を担っています。慢性炎症性肺疾患では、好中球が気道に蓄積し、その結果、過剰に活性化したNSPが肺の破壊と炎症を引き起こします。ブレンソカチブは、DPP1およびそのNSPの活性化を阻害することにより、気管支拡張症などの炎症性疾患への損傷作用を低下させることが期待されます。現在、ブレンソカチブは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
TPIPについて
Treprostinil palmitil inhalation powder(TPIP)は、トレプロスチニルのプロドラッグ乾燥粉末製剤であり、16炭素鎖にエステル結合でトレプロスチニルを連結したものです。TPIPは、すべて当社の研究所で開発され、PAH、PH-ILD、その他の希少かつ重篤な肺疾患患者の治療薬として将来が非常に期待されるプロスタノイドです。TPIPは、カプセル製剤であり、吸入器を使用して投与されます。現在、TPIPは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
INS1201について
INS1201は、デュシェンヌ型筋ジストロフィーの患者に対する治療法として、当社が開発を進めているマイクロジストロフィンを発現するAAV(アデノ随伴ウイルス)を用いた遺伝子治療です。本剤は髄腔内投与により投与され、低用量で骨格筋および心筋の両方を標的としています。現在、INS1201は、世界中のどの国・地域においても、承認されていません。
インスメッドについて
人を第一に考えるグローバルバイオ企業であるインスメッドは、深刻な疾患と生きる患者さんの未来を変える、ファースト・イン・クラスおよびベスト・イン・クラスの治療法の実現を目指しています。当社は既承認薬から、中期から後期開発段階にある治験薬、最もニーズの高い患者コミュニティに提供する先進的な創薬まで、多様なポートフォリオを推進しています。インスメッドの最も進んだ段階にあるプログラムは、米国・日本・欧州で承認された慢性的で衰弱しやすい肺疾患の治療をはじめとする肺疾患と炎症性疾患に関するものです。当社の初期段階の研究プログラムは、遺伝子療法、AIを用いたタンパク質工学、タンパク質製造、RNA端末結合、合成救済など、幅広い技術とモダリティを網羅しています。インスメッドは、米国ニュージャージー州ブリッジウォーターに本社を置き、欧州や日本において事業を展開しています。インスメッドはScience誌のトップエンプロイヤーサーベイで4年連続1位に選ばれ、バイオ医薬品産業で優良企業の1つとして認められています。
日本法人概要
会社名 : インスメッド合同会社
設立日 : 2017年12月5日
住所 : 〒100-0014 東京都千代田区永田町2-10-3 東急キャピトルタワー13階
https://insmed.jp/
Insmed(R), Insmed logo, インスメッド(R), ARIKAYCE(R), アリケイス(R) are registered trademarks of Insmed Incorporated. PARI(R) is a registered trademark of PARI GmbH.ラミラ(R) is registered trademarks of PARI Pharma GmbH. All other trademarks referenced herein are the property of their respective owners.

企業プレスリリース詳細へ
PR TIMESトップへ
この資料は、インスメッド(米国 ニュージャージー州)が2025年2月20日(現地時間)に発表した内容を日本語に翻訳(要約)したもので、参考資料として提供するものです。資料の内容および解釈については、米国における規制等に基づくもの及び英語による記載が優先されます。英語版および関連財務表は、https://insmed.com をご参照下さい。
- アリケイス(R)(アミカシンリポソーム吸入用懸濁液)*の第4四半期の売上高は1億440万ドル、2024年通年では3億6,370万ドルで、年間成長率19%を反映し、2024年通年のガイダンスレンジの上限を超過。
- 2025年のグローバルでのアリケイスの売上予想レンジを4億500万ドルから4億2,500万ドルとし、2024年に比べて二桁の成長を反映。
- 気管支拡張症患者を対象としたブレンソカチブの新薬承認申請(NDA)が米国食品医薬品局(FDA)によって受理され、優先審査の指定を受けた。処方薬ユーザー・フィー法(PDUFA)の目標終了期日は2025年8月12日。
- 肺動脈性肺高血圧症(PAH)患者を対象としたTPIPの第IIb相試験、鼻茸を伴わない慢性副鼻腔炎(CRSsNP)患者を対象としたブレンソカチブの第IIb試験(BiRCh試験)、アリケイスの第III相ENCORE試験は、それぞれ2025年半ば、2025年末、2026年第1四半期にトップラインデータが得られる見込み。
- 2024年末時点で約14億ドルの現金、現金同等物、および市場性のある有価証券を保有。
*日本ではアリケイス吸入液590mg(アミカシン硫酸塩 吸入用製剤)として承認されています。
2025年2月20日、米国ニュージャージー州発 人を第一に考え、深刻な疾患と生きる患者さんの未来を変える、ファースト・イン・クラスおよびベスト・イン・クラスの治療法の実現を目指すグローバルバイオ医薬品企業のインスメッド(Nasdaq: INSM)は、2024年12月31日に終了した第4四半期の業績、ビジネスアップデートを発表しました。
インスメッド会長兼最高経営責任者(CEO)のウィル・ルイスは、「インスメッドの歴史の中で最も重要な年を振り返るにあたり、当社は業界の中でも稀有な立場にあり、今後これまでにない機会が待ち受けていると感じています。2024年は、すべての事業領域における成功、特に気管支拡張症を対象としたブレンソカチブの画期的な第III相ASPEN試験の良好なデータの発表により、重篤な疾患に苦しむ多くの患者さんに治療を届ける可能性が開かれ、企業価値の大幅な向上につながりました。」と述べた上で、「2025年には、FDAの承認を前提に、ブレンソカチブの米国上市に向けた取り組みを進めてまいります。また、FDAから優先審査の指定を受け、NDAを受理されたことで、その目標に一歩近づいたことを大変嬉しく思います。並行して、充実した中期から後期開発パイプラインを引き続き推進し、アリケイスのグローバルでの二桁成長を見込んでいます。インスメッドの強固な財務基盤と独自の企業文化が、支援を必要とする患者さんのために成果を届ける力となると確信しています。」と述べています。
最近の主なハイライト
アリケイス
- アリケイスの2024年の売上高は、2023年に比べて19%増加し、米国、日本、欧州での強力な成長を反映しています。
- 2024年第4四半期に、新たに診断されたか再発したマイコバクテリウム・アビウムコンプレックス(MAC)肺疾患で抗生物質による治療を受けていない患者を対象とした第III相ENCORE試験の登録を完了しました。試験の登録総数は425名です。
- 2026年第1四半期にENCORE試験のトップラインデータの公表を見込んでおり、2026年後半には米国におけるすべての肺MAC症患者を対象にアリケイスのFDAへの適応追加申請(sNDA)を予定しています。
ブレンソカチブ
- 2025年2月、FDAはインスメッドによる気管支拡張症患者を対象としたブレンソカチブの新薬承認申請(NDA)を受領し、優先審査の申請を許可しました。処方薬ユーザー・フィー法(PDUFA)の目標終了期日は2025年8月12日です。薬事承認が得られた場合、引き続き、第3四半期の米国での上市を目指します。
- 欧州、英国および日本でのブレンソカチブの薬事申請は2025年を予定しており、各地域での承認を待って、2026年の上市を予定しています。
- 鼻茸を伴わない慢性副鼻腔炎(CRSnNP)患者を対象としたブレンソカチブの第IIb相試験(BiRCh試験)は、2025年末までにはトップラインデータ結果の公表を予定しています。
- 化膿性汗腺炎(HS)患者を対象としたブレンソカチブの第IIb相試験(CEDAR試験)において投与を開始しました。
TPIP
- 2025年2月1日にPulmonary Vascular Research Instituteの2025年年次世界学術会議において、間質性肺疾患に伴う肺高血圧症(PH-ILD)を対象としたTreprostinil Palmitil Inhalation Powder(TPIP)の第IIa相試験から得られた追加の肺画像データを発表しました。
- TPIPによる治療は、小動脈における血液量の割合を有意に増加させ、プラセボ群と比較して小動脈と大動脈の体積比の改善傾向を示し、小血管の血管拡張および肺細動脈の血流再分布の改善が示唆されました。
- さらに、TPIPで治療を受けた患者において、高吸収異常スコアに数値的な減少が認められました。
- 2025年後半に、間質性肺疾患に伴う肺高血圧症(PH-ILD)患者を対象としたTPIPの第III相試験を開始する予定です。
- TPIPの肺動脈性肺高血圧症(PAH)を対象とした第IIb相試験の登録は2024年12月に完了し、102名の患者に無作為割付けを実施しました。ブレンソカチブの米国上市に先立ち、2025年中頃にこの試験のトップラインデータを公表する予定です。
遺伝子治療
- デュシェンヌ型筋ジストロフィー(DMD)患者を対象とした髄腔内投与遺伝子治療薬INS1201の治験薬申請(IND)において、2024年12月にFDAから許可を取得しました。
- 2025年前半にINS1201の臨床試験を開始する予定です。
- 筋萎縮性側索硬化症(ALS)とスターガルト病を対象とする2つの遺伝子治療候補薬は、現在、治験に向けて準備が進められています。
前臨床プログラム
- 研究開発では、現在開発中の30以上の前臨床プログラムが含まれており、すべてが対象としている適応症に対し、ファースト・イン・クラス、あるいはベスト・イン・クラスの治療法になる可能性があります。
- 前臨床研究プログラムから、年間平均1~2件のIND申請を行う予定です。
- 前臨床研究プログラム全体に対する支出は年間支出全体の20%未満になると予想しています。
2024年第4四半期および通期の業績について
- 以下の表は、米国、日本、欧州およびその他の地域におけるアリケイスの2024年と2023年の第4四半期および年間売上高と売上成長率をまとめたものです。

- 売上原価(無形資産償却費を除く)は、2024年第4四半期に2,620万ドル、2023年第4四半期は1,840万ドルでした。2024年通年の売上原価(無形資産償却費を除く)は8,570万ドルで、2023年通年では6,560万ドルでした。第4四半期および通年における売上原価の増加は、主にアリケイスの売上高の伸びを反映したものです。
- 研究開発(R&D)費用は、2024年第4四半期に1億7,970万ドル、2023年第4四半期は1億3,700万ドルでした。2024年通年のR&D費用は5億9,840万ドルで、2023年通年は5億7,100万ドルでした。第4四半期および通年におけるR&D費用の増加は、主に人員増に伴う報酬および福利厚生関連費用の増加に加え、株式報酬費用の増加によるものです。
- 2024年第4四半期の販売および一般管理費(SG&A)は2023年第4四半期の8,950万ドルに対し1億4,250万ドルでした。2024年通年のSG&A費用は2023年通年の3億4,450万ドルに対し4億6,110万ドルでした。第4四半期および通年におけるSG&A費用の増加は、米国でのブレンソカチブの規制当局承認を前提とした発売準備に伴う人員増加により、報酬および福利厚生関連費用、および株式報酬費用が増加したことによるものです。
- 2024年第4四半期において、インスメッドは純損失として2億3,550万ドル(1株あたり1.32ドル)を報告しました。2023年第4四半期の純損失は1億8,610万ドル(1株あたり1.28ドル)でした。2024年通年において、インスメッドは純損失として9億1,380万ドル(1株あたり5.57ドル)を報告しました。2023年通年の純損失は7億4,960万ドル(1株あたり5.34ドル)でした。
貸借対照表、財政ガイダンス、計画投資について
- 2024年12月31日現在、インスメッドは、合計で約14億ドルの現金、現金同等物、および市場性のある有価証券を保有しています。
- 2025年通年のアリケイスの全世界での売上は2024年と比較して11~17%の年間成長をするという方向性を反映した4億500万~4億2,500万ドルと予測しています。
- 弊社は2025年には以下の主要な活動への投資を計画しています。
(i) 「アリケイス」のグローバルでのさらなる拡大。
(ii) ブレンソカチブについて、米国においては承認取得後の上市、EU、英国及び日本においては薬事申請の準備。
(iii) ブレンソカチブの臨床試験の推進。CRSsNP患者を対象とした第IIb試験(BiRCh試験)およびHS患者を対象としたIIb相試験(CEDAR試験)を含みます。
(iv) アリケイスの臨床試験の推進。現在の適応症の完全承認のためのFDAからの市販後要件を満たすことを目指し、可能性として肺MAC症の全患者への適応拡大を含みます。
(v) TPIPの臨床開発プログラムの推進。PAH患者を対象とした第IIb相試験の推進とPH-ILD患者を対象とした第III相試験の開始を含みます。
(vi) DMDを対象としたINS1201の臨床試験の推進。
(vii) 前臨床研究プログラムの継続的開発。
カンファレンスコール
インスメッドは、2025年2月20日午前8時(米国東部時間)よりカンファレンスコールを実施しました。この会議のウェブキャストは、当社ウェブサイト (www.insmed.com) の投資家情報セクションに90日間保存されます。
アリケイスについて
アリケイスは、米国ではARIKAYCE(R)(Amikacin Liposomal Inhalation Suspension/ALIS, アミカシンリポソーム吸入用懸濁液)、欧州ではARIKAYCE(R) Liposomal 590mg Nebuliser Dispersion、日本ではアリケイス吸入液590mg(アミカシン硫酸塩 吸入用製剤)として承認されています。現在、国際的な治療ガイドラインでは、適切な患者にアリケイスを使用することが推奨されています。アリケイスは、これまで静脈内投与されていたアミカシンを、1日1回、吸入投与する新規製剤です。当社独自のPULMOVANCE(R)リポソーム技術により、アミカシンを肺に直接到達させることで、従来懸念されていた聴覚、平衡感覚、および腎機能といった全身性の副作用の発現を抑えながら、主要な感染細胞である肺マクロファージに取り込まれることを可能としました。アリケイスは、PARI(R) Pharma GmbH(以下、PARI社)社製のラミラ(R) ネブライザシステムを使用して1日1回投与されます。
PARI社とラミラネブライザシステムについて
アリケイスは、PARI社が開発した新しい吸入器であるラミラネブライザシステムによって投与されます。ラミラは、振動する多孔質膜を介してアリケイスを効率的に噴霧することができる、静かで持ち運び可能なネブライザです。PARI社は、エアロゾルに関する100年の知見に基づき、患者の治療を向上させるための革新的な送達プラットフォームの開発を通じて、吸入治療の進歩に貢献しています。
ブレンソカチブについて
ブレンソカチブは、インスメッドが気管支拡張症やその他の好中球介在性疾患の治療薬として開発している低分子の経口ジペプチジルペプチダーゼ1(DPP1)可逆的阻害剤です。DPP1は、好中球が骨髄で形成される際に、好中球エラスターゼなどの好中球セリンプロテアーゼ(NSP)を活性化する酵素です。好中球は白血球の中で最も多く存在し、病原体の破壊や炎症性媒介において不可欠な役割を担っています。慢性炎症性肺疾患では、好中球が気道に蓄積し、その結果、過剰に活性化したNSPが肺の破壊と炎症を引き起こします。ブレンソカチブは、DPP1およびそのNSPの活性化を阻害することにより、気管支拡張症などの炎症性疾患への損傷作用を低下させることが期待されます。現在、ブレンソカチブは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
TPIPについて
Treprostinil palmitil inhalation powder(TPIP)は、トレプロスチニルのプロドラッグ乾燥粉末製剤であり、16炭素鎖にエステル結合でトレプロスチニルを連結したものです。TPIPは、すべて当社の研究所で開発され、PAH、PH-ILD、その他の希少かつ重篤な肺疾患患者の治療薬として将来が非常に期待されるプロスタノイドです。TPIPは、カプセル製剤であり、吸入器を使用して投与されます。現在、TPIPは開発治験段階にあり、世界中のどの国・地域においても、承認されていません。
INS1201について
INS1201は、デュシェンヌ型筋ジストロフィーの患者に対する治療法として、当社が開発を進めているマイクロジストロフィンを発現するAAV(アデノ随伴ウイルス)を用いた遺伝子治療です。本剤は髄腔内投与により投与され、低用量で骨格筋および心筋の両方を標的としています。現在、INS1201は、世界中のどの国・地域においても、承認されていません。
インスメッドについて
人を第一に考えるグローバルバイオ企業であるインスメッドは、深刻な疾患と生きる患者さんの未来を変える、ファースト・イン・クラスおよびベスト・イン・クラスの治療法の実現を目指しています。当社は既承認薬から、中期から後期開発段階にある治験薬、最もニーズの高い患者コミュニティに提供する先進的な創薬まで、多様なポートフォリオを推進しています。インスメッドの最も進んだ段階にあるプログラムは、米国・日本・欧州で承認された慢性的で衰弱しやすい肺疾患の治療をはじめとする肺疾患と炎症性疾患に関するものです。当社の初期段階の研究プログラムは、遺伝子療法、AIを用いたタンパク質工学、タンパク質製造、RNA端末結合、合成救済など、幅広い技術とモダリティを網羅しています。インスメッドは、米国ニュージャージー州ブリッジウォーターに本社を置き、欧州や日本において事業を展開しています。インスメッドはScience誌のトップエンプロイヤーサーベイで4年連続1位に選ばれ、バイオ医薬品産業で優良企業の1つとして認められています。
日本法人概要
会社名 : インスメッド合同会社
設立日 : 2017年12月5日
住所 : 〒100-0014 東京都千代田区永田町2-10-3 東急キャピトルタワー13階
https://insmed.jp/
Insmed(R), Insmed logo, インスメッド(R), ARIKAYCE(R), アリケイス(R) are registered trademarks of Insmed Incorporated. PARI(R) is a registered trademark of PARI GmbH.ラミラ(R) is registered trademarks of PARI Pharma GmbH. All other trademarks referenced herein are the property of their respective owners.

企業プレスリリース詳細へ
PR TIMESトップへ
(2025/03/24 10:00)
- データ提供
-

本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMES ( )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
 )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
























