東京医科歯科大学難治疾患研究所教授で川崎市産業振興財団ナノ医療イノベーションセンター(iCONM)主幹研究員の内田智士氏とiCONMの片岡一則センター長は、杏林大学病理学教室准教授の林玲匡氏らと共同で、くし形メッセンジャーRNA(mRNA)を開発。がんワクチンとしての細胞性免疫誘導作用をマウスで実証し、結果をProc Natl Acad Sci USA(2023; 120: e2214320120)に発表した。
アジュバントに注目
mRNAワクチンは、新型コロナウイルスの感染予防における有効性と安全性が実証され、現在広く普及しており、近年はがん細胞を標的としたmRNAワクチンの研究も行われている。がんmRNAワクチンは、がん細胞に特異的な蛋白質をつくるmRNAを接種することで、攻撃型免疫細胞を活性化したり炎症性サイトカインの分泌を促して異物自体を撃退したりする細胞性免疫の獲得が期待されている。一方、がん細胞は正常細胞と区別しにくく、また免疫システムを回避する免疫逃避機構を有するため、がんワクチンは感染症ワクチンと比べて開発が難しいと考えられている。
そこで、内田氏らはワクチンの免疫活性化の効果を高めるアジュバントに着目。これまでアジュバントを組み込む実験は、膨大な数の候補となる化合物を全て動物実験で試し、最適なものを探すという経験則に基づく方法で行われてきたが、実用に足る結果を得ることはできていなかった。
今回、同氏らは独自のRNA工学の手法を用いて、免疫応答を引き起こす抗原をコードするmRNA鎖にアジュバントを直接組み込む方法を開発した。自然免疫受容体レチノイン酸誘導性遺伝子Ⅰ(RIG-Ⅰ)を標的に短い二本鎖RNA(dsRNA)を設計し、長さや配列を変えてmRNA鎖にくし形に配置した。長さや配列を調節してRIG-Ⅰを刺激すると、がんを攻撃してワクチンの効果を高める樹状細胞を効果的に活性化することに成功した。さらに、mRNA鎖に結合するdsRNAの数を増減することにより、免疫賦活効果の強度を調整できることも示された(図)。アジュバントは作用が強過ぎれば副作用を誘引し、作用が弱ければ十分なワクチン効果が得られないため、作用の強度が調整できることは重要なポイントであるという。
図.くし型mRNAの構造と機序
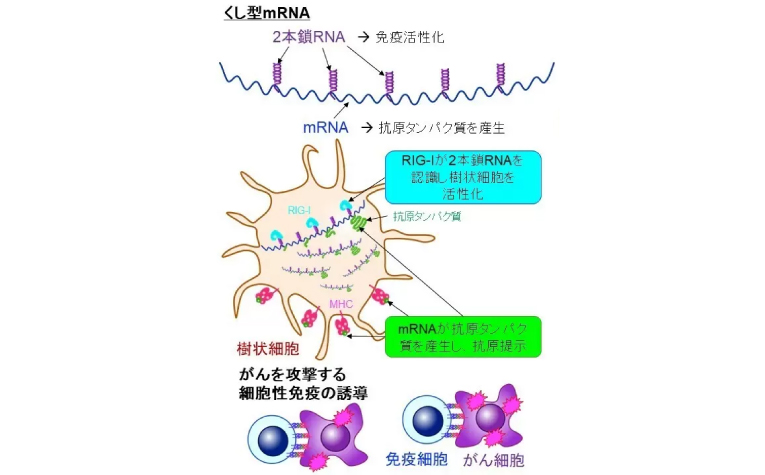
(東京医科歯科大学プレスリリースより)
くし型mRNAは、さまざまなmRNAワクチンの送達システムに搭載することで効果の向上が想定される。マウスを用いて細胞性免疫の活性化を評価する実験では、くし型mRNAをがんワクチンの臨床試験で用いられている脂質粒子に搭載して投与したところ、皮膚がんやリンパ腫のサイズが縮小し、延命効果を確認することができた。
同氏らはくし型mRNAについて「既に開発が進んでいるあらゆるmRNAワクチンの効果を増強できる汎用性の高いシステム」と評価した上で「次世代のがん免疫治療として期待されるがんmRNAワクチンの効果を高めるための中核的基盤技術となる」と展望している。
(服部美咲)
変更履歴:リード文の主体研究機関の記載に誤りがあったため、訂正しました。






















