タキサン系抗悪性腫瘍薬ドセタキセルと、ヒト型抗血管内皮細胞増殖因子受容体(VEGFR)-2モノクローナル抗体ラムシルマブの併用療法は、免疫チェックポイント阻害薬が日常診療で使用可能となる以前に保険承認されていた二次治療の1つ。そのため免疫チェックポイント阻害薬と殺細胞性抗がん薬の併用療法が無効となった後のドセタキセル+ラムシルマブ併用療法の有効性と安全性のさらなる検討が必要とされている。今回、名古屋大学呼吸器内科学の松澤令子氏、講師の森瀬昌宏氏、教授の石井誠氏らは、この問題を検討する多施設共同非盲検シングルアーム第Ⅱ相臨床試験(SCORPION)を実施。奏効率は33.4%で、免疫療法後の二次治療として有望な治療選択肢の1つになるとeClinicalMedicine(11月9日オンライン版)に報告した。
NSCLC患者33例について検討
ドセタキセルはがん細胞が分裂・増殖する上で重要な過程である微小管の脱重合を阻害することで抗がん作用を示す。ラムシルマブは腫瘍血管の新生抑制により抗腫瘍効果を示し、VEGFR-2受容体を阻害してVEGF経路の活性化を抑制することで、がんの微小免疫環境で腫瘍に対する免疫の活性化が示唆されている。このためドセタキセル+ラムシルマブ併用療法は、免疫チェックポイント阻害薬を使用しない治療法と比較して同薬治療後の二次治療としてより高い効果が得られる可能性が示唆されていた。
SCORPION試験では、2020年1月~21年8月に8施設の33例〔平均年齢66歳(範囲42~79歳)〕が登録された。ステージⅣまたは術後再発の非小細胞肺がん(NSCLC)例で、殺細胞性抗がん薬+免疫チェックポイント阻害薬療法による初回治療が無効となり、全身状態が良好な患者を対象に、ドセタキセル+ラムシルマブ併用療法の有効性および安全性を検討。レジメンはドセタキセル60mg/m2+ラムシルマブ10mg/kg(1日目)、顆粒球コロニー形成刺激因子(G-CSF)製剤ペグフィルグラスチム3.6mg(2日目)を3週ごとに投与した。化学放射線療法と抗PD-L1抗体の併用療法を一次治療として受けたステージⅢの1例を除く32例について有効性を検討。安全性は33例で検討を行った。主要評価項目は奏効率(ORR)、副次評価項目は全生存(OS)、無増悪生存(PFS)、安全性とした。
78%に腫瘍縮小を認める
データカットオフ時点(2022年5月25日)で、2例が進行することなく試験治療を継続し、30例が中止した(病勢進行13例、有害事象12例、患者の希望2例、6週間を超える治療延期3例)。中止の原因となった有害事象は、体液貯留・浮腫4例、薬剤性肺炎3例、出血事象2例、遷延性血小板減少症、クレアチニン増加、せん妄・認知障害が各1例だった。
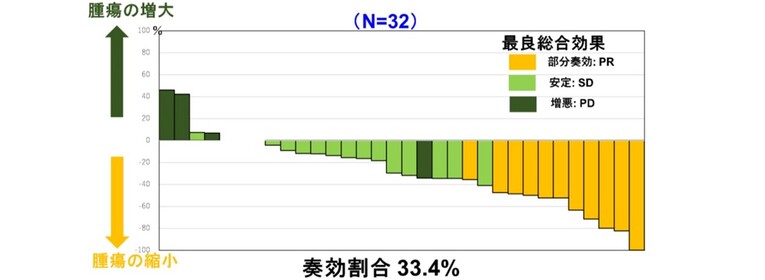
解析の結果、主要評価項目のORRは34.4%(80%CI 23.1~47.2%、95%CI 18.6~53.2%)で、病勢コントロール率は81.3%(95%CI 63.6~92.8%)だった。また、78%が腫瘍縮小を示し、EGFR活性化変異の有無や組織学的サブタイプに関係なく観察された(図)。
PFSは6.5ヵ月(95%CI 4.4~8.2ヵ月)で、OS中央値は17.5ヵ月〔95%CI 11.3ヵ月~未到達(NR)〕、18ヵ月OS率は49.0%であった。
図. ドセタキセル+ラムシルマブ併用療法による腫瘍径の総和の最大変化率
(名古屋大学プレスリリースより)
治療関連死は発生せず
安全性については33例で評価した。治療緊急性のあるAEが全例で報告され、グレード4の有害事象として好中球減少症が12%に見られた。グレード3の発熱性好中球減少症の発生率は9%、出血イベントは33%(グレード3は6%)、肺炎は12%(グレード3は9%)に認められた。非血液学的な有害事象としては、倦怠感(64%)、食欲不振(64%)、脱毛症(58%)の頻度が高かった。重篤な有害事象は19件報告されたが、治療関連死は発生しなかった。
以上の結果から、松澤氏らは「副作用に対する注意は必要だが、ドセタキセル+ラムシルマブ併用療法は、免疫チェックポイント阻害薬と殺細胞性抗がん薬の併用療法が無効となった患者に対し有望な治療選択肢の1つであることが示唆された」と結論。「今回の結果が日常診療でNSCLCに対する二次治療を決定する際に参考となりうることが期待される」と展望した。
(栗原裕美)






















