 遺伝性網膜ジストロフィー(IRD)は遺伝子変異により網膜の機能に障害が生じ、成人までに約半数が社会的失明に至る進行性の網膜疾患である。その1つである両アレル性RPE65遺伝子変異によるIRDに対する治療薬として、今年(2023年)6月26日に製造販売承認されたのが眼科領域初の遺伝子治療薬ボレチゲン ネパルボベク(商品名ルクスターナ注)である。8月4日に開催されたノバルティス ファーマ主催のメディアセミナーでは、同薬の国内臨床試験を主導した国立病院機構東京医療センター眼科/臨床研究センター視覚生理学研究室室長の藤波芳氏が国内外の第Ⅲ相臨床試験の結果を解説。「日本人患者においても視機能の改善と安全性が初めて認められた」と報告した。
遺伝性網膜ジストロフィー(IRD)は遺伝子変異により網膜の機能に障害が生じ、成人までに約半数が社会的失明に至る進行性の網膜疾患である。その1つである両アレル性RPE65遺伝子変異によるIRDに対する治療薬として、今年(2023年)6月26日に製造販売承認されたのが眼科領域初の遺伝子治療薬ボレチゲン ネパルボベク(商品名ルクスターナ注)である。8月4日に開催されたノバルティス ファーマ主催のメディアセミナーでは、同薬の国内臨床試験を主導した国立病院機構東京医療センター眼科/臨床研究センター視覚生理学研究室室長の藤波芳氏が国内外の第Ⅲ相臨床試験の結果を解説。「日本人患者においても視機能の改善と安全性が初めて認められた」と報告した。
細胞内でエピソーム形成、RPE65蛋白質の産生を維持
IRDは遺伝子変異による網膜疾患の総称を示し、症状としては夜盲から始まり、視野障害、視力障害、羞明・昼盲へと進展する。260を超える原因遺伝子が特定されており、中でもRPE65遺伝子変異はレーベル先天黒内障(LCA)や網膜色素病変症(RP)など複数のIRDの発症に関与している。RPE65蛋白質は視物質の1種で視覚サイクルにおいて光感受性に関与しており、それをコードするRPE65遺伝子が変異すると光感受性が低下する。そのため、RPE65遺伝子変異によるIRDでは3~5歳の幼少期から強い夜盲が見られ、成長に伴い失明に至る。
ボレチゲン ネパルボベクは、これまで有効な治療法がなかった両アレル性RPE65遺伝子変異によるIRDに対する治療薬である。同薬はアデノ随伴ウイルス2型(AAV2)ベクターを用いた遺伝子治療薬で、1.5×1011ベクターゲノム/0.3mLを各眼の網膜下に単回投与する(図1)。AAV2ベクターが網膜色素上皮細胞に取り込まれることでRPE65蛋白質が産生され、光感受性が改善する。さらに、細胞分裂能が低い網膜色素上皮細胞内でエピソーム(染色体とは別に維持される独立した環状DNA)を形成し導入した遺伝子が維持されるため、1回の投与で長期の効果が期待できるという。
図1. 網膜下投与手技
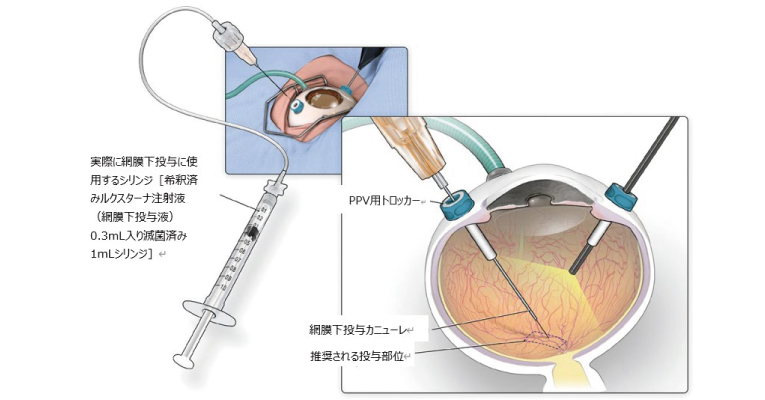
(メディアセミナー発表資料)
同薬の対象は、両アレル性RPE65遺伝子変異が確認され、かつ十分な生存網膜細胞を有する例である。加えて、同薬の投与前後には免疫応答のリスク低減を目的としてステロイド薬(プレドニゾロン)を用いることから、ステロイド薬の使用が可能な患者となる。また、手術下での投与となるため、網膜硝子体手術に熟練した眼科医による施術が必要である。
6年間にわたる長期の視力改善を維持
米国における第Ⅲ相ランダム化比較試験では、両アレル性RPE65遺伝子変異を有するIRD 31例を介入(投与)群(21例)と対照群(10例)に分け、投与1年後に評価を行った(Lancet 2017; 390: 849-860)。投与方法については、免疫的な点から1眼目の投与から6~18日後に2眼目に投与した。主要評価項目はMLMT*(Multi-luminance Mobility Test)、副次評価項目はFST**(Full-field Sensitivity Threshold/Full-field Stimulus Threshold)とし、投与1年後におけるベースラインからの両眼平均変化量を評価した。
主要評価項目のMLMTは、介入群が1.8±1.1、対照群が0.2±1.0、群間差は1.6(95%CI 0.72~2.41、P=0.0013)と介入群で有意に改善、副次評価項目のFSTも介入群が-2.10±1.58、対照群が0.04±0.28と介入群で改善し、いずれも30日で効果が見られた。また、同試験では対照群に対しても1年後からボレチゲン ネパルボベクの投与を行い長期の経過観察を実施しており、介入群では6年、対照群では5年の長期の視力維持が確認されている。
安全性については、主な有害事象は頭痛(45%)、白血球増加症(38%)、悪心(34%)、嘔吐(34%)、発熱(34%)、治験製品に関連したものは網膜沈着物(10%)が見られ、投与手技に関連したものは66%だった。中止や死亡の報告はなかった。
日本人において光感受性が100倍に上昇
国内における第Ⅲ相臨床試験A11301では、日本人における両アレル性RPE65遺伝子変異を有するLCA 2例とRP 2例を対象に5年間の経過観察を行い、有効性と安全性を評価した。投与方法は、米国の試験と同様に1眼目の投与から6~18日後に2眼目に投与した。主要評価項目は夜盲を評価する観点からFST(白色光を視標)のベースラインからの平均変化量、副次評価項目は視野(GoldmannⅢ4eおよびV4e指標)と視力(Langeスケール)のベースラインからの平均変化量とした。
主要評価項目のFSTは、全例でベースラインからの改善が見られ、1年後の両眼平均変化量は-1.831log10(cd・s・m-2)と100倍近い感度の上昇が確認された(図2)。副次評価項目は、視野についてはⅢ4e指標の平均変化量で427.8平方度の視野増加(増加2例、不変2例)、V4e指標で200.5平方度の視野増加(増加3例、不変1例)が見られた。視力については、1例で手動弁(手掌の上下左右の動きが区別できる)から指数弁(指の本数が判別できる)への改善が得られた。
図2. A11301におけるFSTの両眼平均変化量
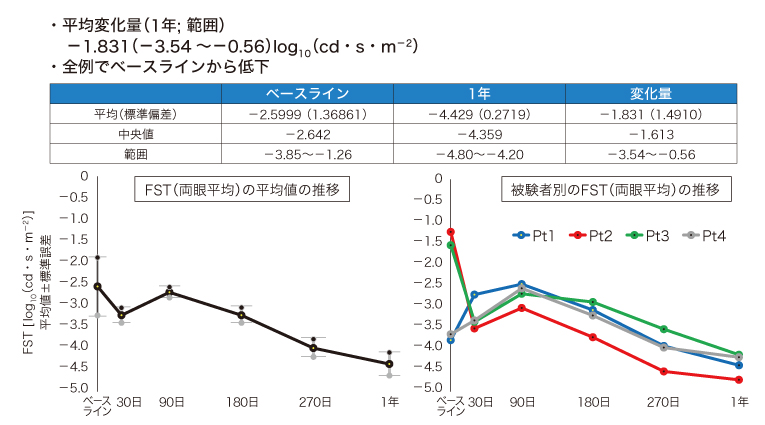
(メディアセミナー発表資料を基に編集部作成)
安全性については、主な有害事象は白血球増加症(100%)、便秘(50%)であり、これらはステロイド薬の使用による影響が考えられるという。投与手技に関連するものとしては、縫合部の違和感(ごろごろ感)としての眼痛(50%)が見られた。治験製品に関連するものはなく、中止や死亡の報告はなかった。
藤波氏は「国内の臨床試験は現在も進行中であり、引き続き長期の経過観察を行っている。また、製造販売後調査として5年間で15症例を目標に有効性を検証する計画であり、日本人における長期の有効性と安全性の確認を進めたい」と展望した。
*MLMT:異なる照度下で決められたコースを正確かつ妥当な速度で歩行移動できる能力を評価する指標。スコア上昇で改善
**FST:光刺激による全視野の網膜感度と閾値を測定する検査。スコア低下で改善
(山路唯巴)






















