腎臓の糖新生を制御する臓器間ネットワークを世界に先駆けて解明!―ケトン体が腎臓による血糖、酸・塩基バランスのコントロールに一役―
国立大学法人千葉大学
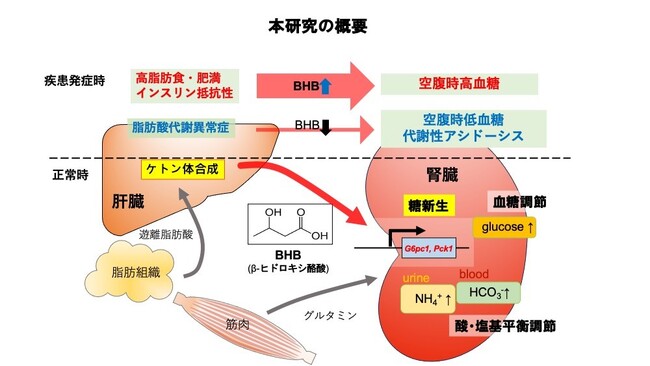
千葉大学大学院医学研究院 波多野亮助教、三木隆司教授、田中知明教授、平原潔教授、薬学研究院 佐藤洋美准教授らの研究グループは、筑波大学医学医療系 島野仁教授、富山大学和漢医薬学総合研究所 中川嘉教授の研究グループとの共同研究により、腎臓の糖新生(注1)を制御する新たなメカニズムの解明に成功しました。 研究グループは、空腹時の血糖維持に関わる腎糖新生の調節に肝臓で合成されるケトン体(注2)が、空腹時の代替エネルギー源としてだけでなく、生理活性物質として血糖調節や血液の酸性化(アシドーシス)を防ぐという重要な役割を担っていることを新たに発見しました。 ケトン体が、臓器間(肝臓―腎臓)の代謝機能をつなぐメディエーターとして働くことで生体の機能恒常性の維持に関わる重要な物質であることを世界で初めて明らかにした本研究は、腎臓の糖新生を標的とする新たな薬物等の開発により肥満症や糖尿病の治療法の開発に革新的な道を拓く可能性があります。 本研究成果は、令和6年4月9日付で国際学術誌Molecular Metabolismにオンライン掲載されました。
研究の背景と経緯
糖新生は空腹時にエネルギー源である糖(グルコース)を作り出す重要な生理機能の一つで、空腹期間が続いても血糖値を一定に保つ役割を担っています。これまでは肝臓が糖新生を行う主な臓器だと考えられていましたが、最近では腎臓が糖新生機能を持つもう一つの臓器として注目されています。しかし、腎臓の糖新生を調節するメカニズムには不明な点が多く、どのように調節されているかは十分に解明されていませんでした。
研究グループは、マウスにおいて腎臓の糖新生に関わる遺伝子の発現と血中のケトン体(ここでは主たるケトン体であるβ-ヒドロキシ酪酸(BHB)を指す)濃度との間に相関関係があることを見つけ、ケトン体による腎臓の糖新生の調節について検証しました。
研究の内容
空腹時のマウスの血中ケトン体濃度が腎臓の糖新生関連酵素であるG6pc1やPck1の遺伝子発現と相関したことから、空腹時に高ケトン血症を示す肥満マウスやインスリン抵抗性を示すマウスで調べたところ、G6pc1やPck1発現がさらに上昇することがわかりました。ケトン体の投与やケトン食(注3)の給餌によっても血中のケトン体濃度に比例して腎G6pc1、Pck1遺伝子発現が上昇しました。一方で、ケトン体合成が障害されたPPARα(Peroxisome Proliferator-activated Receptor α(注4))欠損マウスでは、空腹時に腎糖新生が誘導されず空腹時低血糖を呈することがわかりました。しかし、ケトン体の投与によってこの空腹時低血糖が改善されました。これらの結果からケトン体が腎臓の糖新生を調節する重要なレギュレーターであると考えられました。
培養細胞での実験においても、ケトン体刺激により、細胞内のグルタミンを利用したグルコース合成が促されることがわかりました。また、腎糖新生はグルタミンというアミノ酸を利用して尿中にNH4+として酸を排泄する役割も担っていますが、マウス尿細管を用いた実験ではケトン体はグルタミンからのNH3産生とグルコース産生を亢進させることが確認されました。
したがってケトン体は腎糖新生を調節することで血糖と酸・塩基平衡の調節をしているものと考えられます。
今後の展望
ケトン体の血中濃度の上昇は肥満症患者や糖尿病患者においても見られ、今回発見した腎糖新生を調節するメカニズムは、これらの患者における空腹時高血糖の一因となる可能性が考えられます。1型糖尿病患者で見られる糖尿病性ケトアシドーシスは、ケトン体による腎臓における酸・塩基調節機能の能力を上回る量のケトン体が産生されてしまうことによって生じるものと考えられます。一方で、ケトン体合成機能が低下した脂肪酸代謝異常症では、空腹時低血糖や代謝性アシドーシスが生じることから、正常な生理機能の維持においてもこのケトン体を介した腎糖新生制御機構が重要であるものと考えられます。
本研究の成果は、腎臓の糖新生が果たす生理学的役割や肥満症、糖尿病、脂肪酸代謝異常症などの疾患における血糖調節異常などの原因を明らかにするとともに、新たな治療法の開発につながることが期待されます。
用語解説
注1) 糖新生: 飢餓時に不足するブドウ糖(グルコース)を補うために、アミノ酸や乳酸、グリセロールなどの異なる栄養素から糖を作り出す経路。G6pc1がコードするG6PaseやPck1がコードするPEPCKが律速酵素として働く。
注2) ケトン体: 飢餓時に不足したブドウ糖の代わりに、代替エネルギー源として遊離脂肪酸から合成される化合物。生体ではβ-ヒドロキシ酪酸(BHB)が最も多いが、アセト酢酸、アセトンと合わせた3分子がケトン体と総称される。
注 3) ケトン食: ケトジェニックダイエットとも呼ばれ、食事中の糖質を脂質などに置き換えることで血糖上昇を抑え、代わりに肝臓でのケトン体の合成を促す飢餓模倣食。
注4) PPARα: α型ペルオキシソーム増殖活性化受容体。肝臓では脂肪酸のβ酸化やケトン体生成に関連する遺伝子の発現を調節する転写因子として働く。
論文情報
論文タイトル: Hepatic ketone body regulation of renal gluconeogenesis
著者: Ryo Hatano, Eunyoung Lee, Hiromi Sato, Masahiro Kiuchi, Kiyoshi Hirahara, Yoshimi Nakagawa, Hitoshi Shimano, Toshinori Nakayama, Tomoaki Tanaka, Takashi Miki
雑誌名: Molecular Metabolism
DOI: https://doi.org/10.1016/j.molmet.2024.101934
研究プロジェクトについて
本研究は、以下の支援を受けて遂行されました。 (研究代表者: 波多野 亮助教)
・日本学術振興会・科学研究費補助金基盤研究(C) 2023年度~2025年度
「臓器間ネットワークを介した腎糖新生制御とその生理学的役割」
・日本糖尿病学会 若手研究助成2020年度~2021年度
「臓器間ネットワークを介した腎糖新生制御機構の解明」
・鈴木万平糖尿病財団 若手研究助成2023年度~2024年度
「臓器間ネットワークを介した腎糖新生制御機構の解明」
企業プレスリリース詳細へ
PR TIMESトップへ
千葉大学大学院医学研究院 波多野亮助教、三木隆司教授、田中知明教授、平原潔教授、薬学研究院 佐藤洋美准教授らの研究グループは、筑波大学医学医療系 島野仁教授、富山大学和漢医薬学総合研究所 中川嘉教授の研究グループとの共同研究により、腎臓の糖新生(注1)を制御する新たなメカニズムの解明に成功しました。 研究グループは、空腹時の血糖維持に関わる腎糖新生の調節に肝臓で合成されるケトン体(注2)が、空腹時の代替エネルギー源としてだけでなく、生理活性物質として血糖調節や血液の酸性化(アシドーシス)を防ぐという重要な役割を担っていることを新たに発見しました。 ケトン体が、臓器間(肝臓―腎臓)の代謝機能をつなぐメディエーターとして働くことで生体の機能恒常性の維持に関わる重要な物質であることを世界で初めて明らかにした本研究は、腎臓の糖新生を標的とする新たな薬物等の開発により肥満症や糖尿病の治療法の開発に革新的な道を拓く可能性があります。 本研究成果は、令和6年4月9日付で国際学術誌Molecular Metabolismにオンライン掲載されました。
研究の背景と経緯
糖新生は空腹時にエネルギー源である糖(グルコース)を作り出す重要な生理機能の一つで、空腹期間が続いても血糖値を一定に保つ役割を担っています。これまでは肝臓が糖新生を行う主な臓器だと考えられていましたが、最近では腎臓が糖新生機能を持つもう一つの臓器として注目されています。しかし、腎臓の糖新生を調節するメカニズムには不明な点が多く、どのように調節されているかは十分に解明されていませんでした。
研究グループは、マウスにおいて腎臓の糖新生に関わる遺伝子の発現と血中のケトン体(ここでは主たるケトン体であるβ-ヒドロキシ酪酸(BHB)を指す)濃度との間に相関関係があることを見つけ、ケトン体による腎臓の糖新生の調節について検証しました。
研究の内容
空腹時のマウスの血中ケトン体濃度が腎臓の糖新生関連酵素であるG6pc1やPck1の遺伝子発現と相関したことから、空腹時に高ケトン血症を示す肥満マウスやインスリン抵抗性を示すマウスで調べたところ、G6pc1やPck1発現がさらに上昇することがわかりました。ケトン体の投与やケトン食(注3)の給餌によっても血中のケトン体濃度に比例して腎G6pc1、Pck1遺伝子発現が上昇しました。一方で、ケトン体合成が障害されたPPARα(Peroxisome Proliferator-activated Receptor α(注4))欠損マウスでは、空腹時に腎糖新生が誘導されず空腹時低血糖を呈することがわかりました。しかし、ケトン体の投与によってこの空腹時低血糖が改善されました。これらの結果からケトン体が腎臓の糖新生を調節する重要なレギュレーターであると考えられました。
培養細胞での実験においても、ケトン体刺激により、細胞内のグルタミンを利用したグルコース合成が促されることがわかりました。また、腎糖新生はグルタミンというアミノ酸を利用して尿中にNH4+として酸を排泄する役割も担っていますが、マウス尿細管を用いた実験ではケトン体はグルタミンからのNH3産生とグルコース産生を亢進させることが確認されました。
したがってケトン体は腎糖新生を調節することで血糖と酸・塩基平衡の調節をしているものと考えられます。

今後の展望
ケトン体の血中濃度の上昇は肥満症患者や糖尿病患者においても見られ、今回発見した腎糖新生を調節するメカニズムは、これらの患者における空腹時高血糖の一因となる可能性が考えられます。1型糖尿病患者で見られる糖尿病性ケトアシドーシスは、ケトン体による腎臓における酸・塩基調節機能の能力を上回る量のケトン体が産生されてしまうことによって生じるものと考えられます。一方で、ケトン体合成機能が低下した脂肪酸代謝異常症では、空腹時低血糖や代謝性アシドーシスが生じることから、正常な生理機能の維持においてもこのケトン体を介した腎糖新生制御機構が重要であるものと考えられます。
本研究の成果は、腎臓の糖新生が果たす生理学的役割や肥満症、糖尿病、脂肪酸代謝異常症などの疾患における血糖調節異常などの原因を明らかにするとともに、新たな治療法の開発につながることが期待されます。
用語解説
注1) 糖新生: 飢餓時に不足するブドウ糖(グルコース)を補うために、アミノ酸や乳酸、グリセロールなどの異なる栄養素から糖を作り出す経路。G6pc1がコードするG6PaseやPck1がコードするPEPCKが律速酵素として働く。
注2) ケトン体: 飢餓時に不足したブドウ糖の代わりに、代替エネルギー源として遊離脂肪酸から合成される化合物。生体ではβ-ヒドロキシ酪酸(BHB)が最も多いが、アセト酢酸、アセトンと合わせた3分子がケトン体と総称される。
注 3) ケトン食: ケトジェニックダイエットとも呼ばれ、食事中の糖質を脂質などに置き換えることで血糖上昇を抑え、代わりに肝臓でのケトン体の合成を促す飢餓模倣食。
注4) PPARα: α型ペルオキシソーム増殖活性化受容体。肝臓では脂肪酸のβ酸化やケトン体生成に関連する遺伝子の発現を調節する転写因子として働く。
論文情報
論文タイトル: Hepatic ketone body regulation of renal gluconeogenesis
著者: Ryo Hatano, Eunyoung Lee, Hiromi Sato, Masahiro Kiuchi, Kiyoshi Hirahara, Yoshimi Nakagawa, Hitoshi Shimano, Toshinori Nakayama, Tomoaki Tanaka, Takashi Miki
雑誌名: Molecular Metabolism
DOI: https://doi.org/10.1016/j.molmet.2024.101934
研究プロジェクトについて
本研究は、以下の支援を受けて遂行されました。 (研究代表者: 波多野 亮助教)
・日本学術振興会・科学研究費補助金基盤研究(C) 2023年度~2025年度
「臓器間ネットワークを介した腎糖新生制御とその生理学的役割」
・日本糖尿病学会 若手研究助成2020年度~2021年度
「臓器間ネットワークを介した腎糖新生制御機構の解明」
・鈴木万平糖尿病財団 若手研究助成2023年度~2024年度
「臓器間ネットワークを介した腎糖新生制御機構の解明」
企業プレスリリース詳細へ
PR TIMESトップへ
(2024/04/22 10:02)
- データ提供
-

本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMES ( )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
 )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
























