2025/06/23 17:55
ISHA 2025へようこそ!
ISHA – 国際股関節保存学会は、2025年10月2日から4日まで、日本の…
全身にくまなく張り巡らされた血管は、あらゆる臓器に酸素と栄養を届けることにより、わたしたちの健康を維持しています。一方、動脈硬化・高血圧・糖尿尿などが原因となって血管が障害されると、さまざまな病気を発症します。たとえば糖尿病の方の目の奥では、網膜の血管が詰まることにより、光を感じる神経細胞が酸素不足に陥ります。こうした状態では、神経細胞やグリア細胞が血管内皮細胞増殖因子(VEGF)などを分泌することにより、あたらしい血管を作らせようとします。しかし、これらの新生血管は正しい方向に伸びないため、網膜の低酸素を改善しないばかりか、出血や網膜剥離の原因となります。糖尿病網膜症に加えて、加齢黄斑変性や未熟児網膜症などでも、無秩序な新生血管により失明に至る危険性が高まります。
これらの病気に対する治療では、血管新生を抑制するためにVEGF阻害薬が眼内に投与されています。しかし十分な効果が得られないこともあり、新たな薬の開発が待望されています。とくに糖尿病網膜症では、新生血管が伸びる方向を網膜内に誘導できれば、画期的な血管再生療法の開発につながるものと期待されます。
血管壁の内側は、一層の内皮細胞により縁取られています。新生血管では、VEGFが内皮細胞の前向き運動を、セマフォリン3E(Sema3E)が後ろ向き運動を促進する結果、隣り合う内皮細胞が互いの位置を変えながら前後に動くことが知られています。しかし、これらの相反するシグナルを同時に受け取った内皮細胞が、いかにして動く方向を決めるのかについては、明らかにされていませんでした。
名古屋市立大学の植村明嘉客員教授(国立循環器病研究センター研究所客員部長兼任)は、大阪大学の福嶋葉子特任講師らと共同で、新生血管の内皮細胞では低分子量G蛋白質RhoJが、VEGFシグナルとSema3Eシグナルを統合して前向き・後ろ向き運動のいずれをも制御すること、さらにRhoJを標的とした治療により網膜の異常血管新生を抑制できることを世界で初めて発見し、国際科学誌「THE EMBO JOURNAL」に報告しました(図1)。
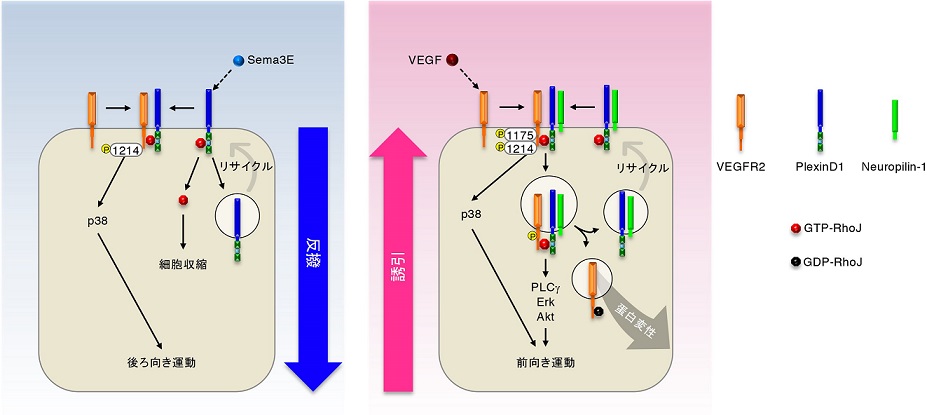
図1. RhoJの多面的機能による内皮細胞運動の制御
植村客員教授らは、目の病気に限らず、がんの血管新生においてもRhoJが重要な働きをもつことを以前に報告しており(Cancer Cell 2014)、RhoJを標的とした新薬が、さまざまな疾患の治療に応用される可能性が期待されます。
ポイント
・糖尿病網膜症やがんでは、血管新生が病気の悪化と関連します。
・新生血管の内皮細胞はVEGFに近づき、Sema3Eから遠ざかる方向に動きます。
・VEGFはVEGFR2受容体に、Sema3EはPlexinD1受容体に結合することにより、内皮細胞が動く方向を調節します。
・内皮細胞では、PlexinD1の細胞内ドメインにGTP型(活性型)RhoJが結合します。
・Sema3EがPlexinD1に結合すると、GTP型RhoJがPlexinD1から解離して細胞を収縮させます。
・PlexinD1に結合したGTP型RhoJは、Sema3E刺激後にPlexinD1-VEGFR2複合受容体の形成を介して、内皮細胞の後ろ向き運動を促進します。
・VEGFに刺激された内皮細胞では、GTP型RhoJがVEGFR2-PlexinD1-Neuropilin-1複合受容体の形成を介して、内皮細胞の前向き運動を促進します。
・VEGF刺激から一定の時間が経過すると、GDP型(不活性型)に転換したRhoJが VEGFR2蛋白質を変性させることにより、細胞内シグナル伝達が終了します。
・虚血に陥った網膜において内皮細胞のRhoJを欠失させると、血管新生が著明に抑制されます。
(2020/04/30 18:36)
2025/06/23 17:55
ISHA 2025へようこそ!
ISHA – 国際股関節保存学会は、2025年10月2日から4日まで、日本の…
2025/06/06 12:24
第14回日本認知症予防学会学術集会
この度、第14回日本認知症予防学会学術集会の大会長を拝命いたしま…