中等症〜重症乾癬の小児患者は全身療法を必要とするが、選択肢は限られているのが現状である。米・Stollery Children's Hospital University of AlbertaのLoretta Fiorillo氏らは、小児尋常性乾癬患者における経口ホスホジエステラーゼ(PDE)4阻害薬アプレミラストの有効性と安全性を検証する第Ⅲ相プラセボ対照ランダム化比較試験(RCT)SPROUTを実施。アプレミラストは小児乾癬の改善に有効であり、年齢、体重、重症度にかかわらず効果は一貫していたとJ Am Acad Dermatol(2024; 90: 1232-1239)に発表した。(関連記事「中等症~重症の乾癬に経口roflumilastが有効」)。
小児は注射嫌い、求められる経口薬の選択肢
乾癬患者に処方される生物学的製剤や免疫抑制薬の多くは小児に対し未承認のため、小児患者では適応外で使用されている。しかし、小児を対象にこれら薬剤の有効性を検討した臨床試験はほとんどない。また、小児は注射に恐怖心を抱く場合が多く、乾癬患児への生物学的製剤の使用はしばしば困難を伴う。こうした観点から、小児乾癬治療において経口薬の選択肢を増やすことが求められている。
アプレミラストは炎症反応を免疫調節する経口PDE4阻害薬であり、尋常性乾癬、関節症性乾癬、ベーチェット病に伴う口腔潰瘍を有する成人への使用が各国で承認されている。Fiorillo氏らは今回、中等症〜重症の尋常性乾癬患児におけるアプレミラストの有効性と安全性を評価する第Ⅲ相多施設二重盲検並行群間RCT・SPROUTを行った。
6~17歳の中等症~重症尋常性乾癬患児が対象
対象は、外用療法によるコントロールが不十分または外用療法が不適応な6~17歳の中等症~重症尋常性乾癬患児〔乾癬重症度指標(PASI)スコア12点以上、体表面積に占める皮疹の割合(BSA)10%以上、医師による皮疹の重症度の総合評価(sPGA)スコア3点以上〕。年齢層別(6~11歳/12~17歳)にアプレミラスト群(163例)とプラセボ群(82例)に2:1でランダムに割り付け、16週間追跡した。アプレミラスト投与量は、体重20~50kgの場合は20mg×2回/日、50kg以上の場合は30mg×2回/日とした。
主要評価項目はsPGA反応率〔2点以上改善し、0点(消失)/1点(ほぼ消失)を達成した割合〕、主要副次評価項目はPASI-75達成率(PASIスコアがベースラインから75%以上改善した割合)とし、ベースラインの年齢(6~11歳 vs. 12~17歳)、体重(20~50kg vs. 50kg)、乾癬重症度〔中等症(sPGAスコア3点) vs. 重症(sPGAスコア4点)〕別のサブグループ解析を行った。また、探索的評価項目としてPASI-90達成率(90%以上改善した割合)を設定した。
245例中221例(90.2%)が16週間の治療を完了
アプレミラスト投与量は20mg×2回/日が80例、30mg×2回/日が83例。平均年齢は12歳で、6~11歳が101例(41.2%)、12~17歳が144例(58.8%)。平均体重は52kgで、20〜50kgが120例(49.0%)、50kgが125例(51.0%)、尋常性乾癬平均罹病期間は4年だった。
平均PASIスコアは19.8で、ベースライン時のsPGAスコアは3点(中等症)が75.5%、4点(重症)が24.5%だった。PASIとBSAは、いずれも6~11歳に比べ12〜17歳で高かった(PASI:18.5% vs. 20.8%、BSA:27.6% vs. 34.3%)。
16週間の治療を完了したのは245例中221例(90.2%)で、24例が治療を中止した〔アプレミラスト群14例(8.6%)、プラセボ群10例(12.2%)〕。主な中止理由は、患者または保護者からの申し出が13例(5.3%)、有害事象の発現が6例(2.4%)だった。
sPGA、PASIのいずれもアプレミラスト群で有意に改善
16週時のsPGA反応率は、プラセボ群の11.5%に対しアプレミラスト群では33.1%と有意に高かった(P<0.0001)。PASI-75およびPASI-90の達成率についても、プラセボ群に比べアプレミラスト群でいずれも有意に高かった(順に16.1% vs. 45.4%. P<0.0001、4.9% vs. 25.2%. 名目上のP=0.0001、図)。
図.16週時のsPGA反応率およびPASI-75/90達成率
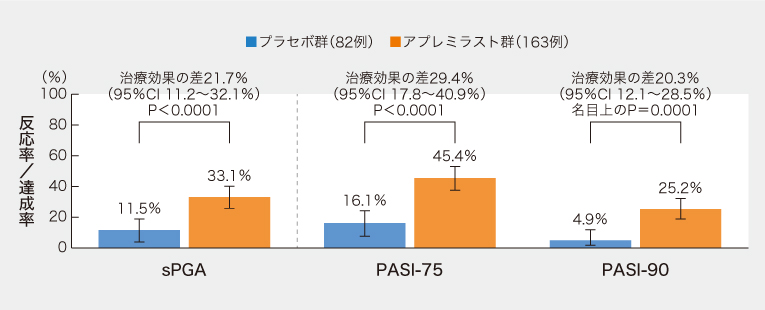
(J Am Acad Dermatol 2024; 90: 1232-1239)
サブグループ解析では、アプレミラスト群は年齢や体重に関係なく、sPGA反応率においてプラセボ群に対する一貫した有益性が示された。年齢層別、体重別にsPGA反応率を見ると、アプレミラスト群では12〜17歳(21.5%)に比べ6~11歳(49.6%)で高く、50kg以上(19.2%)に比べ20~50kg(47.4%)で高かった。
ベースラインの重症度別の評価では、重症患児と比べ中等症患児においてプラセボ群に対するアプレミラスト群のsPGA、PASI-75改善効果の差が大きかった。また、sPGA反応率は乾癬の罹病期間が長い(5年以上)患児に比べ短い(5年未満)患児で高く、生物学的製剤または全身治療薬の使用歴がない患児において高い傾向が見られた。
重篤な有害事象は見られず
安全性について、治療に起因する有害事象(TEAE)はアプレミラスト群で65.0%、プラセボ群で41.3%に認められた。重篤または重大なTEAEを経験した例はほとんどなかった。最も一般的なTEAEは下痢、吐き気、腹痛で、休薬に関連したものは少なかった(アプレミラスト群3.1%、プラセボ群1.3%)。
以上から、Fiorillo氏らは「アプレミラストは中等症〜重症の尋常性乾癬を有する6~17歳の小児において、プラセボと比べ効果的に重症度を改善した。体重および年齢別のサブグループにおいても、一貫して良好な治療効果が観察された」と総括。乾癬患児に対する経口全身治療薬としてアプレミラストの使用を支持する結果であり、特に注射を嫌がる小児にとって有益であろうとの見解を示している。
(編集部)


























