フラビウイルスのコア蛋白質に共通の核輸送担体の同定
学校法人 順天堂
― 広範なフラビウイルスに対する治療標的としての可能性を示唆 ―
順天堂大学大学院医学研究科微生物学の伊東祐美助教、岡本徹主任教授らは、国立研究開発法人医薬基盤・健康・栄養研究所生体機能分子制御プロジェクトの宮本洋一主任研究員との共同研究により、広範なフラビウイルス(※1)で保存されているコア蛋白質(※2)の核局在の意義および核移行のメカニズムを検討し、1.フラビウイルスのコア蛋白質を核に輸送する因子としてインポーチン7(Importin-7:IPO7)を同定し、2.IPO7を介したコア蛋白質の核移行が感染性ウイルスの細胞外への放出に重要であることを明らかにしました。研究成果は、国際科学誌PLOS Pathogens誌に、2024年8月15日午後2時(米国東部夏時間)にオンライン版で発表されました。
■ 本研究成果のポイント
フラビウイルス科ウイルスに共通のコア蛋白質の核移行を担う因子としてIPO7を同定しました。
IPO7がない細胞では、コア蛋白質の核移行の阻害および感染性ウイルス粒子の産生抑制が、日本脳炎ウイルスだけでなくデングウイルスやジカウイルスでも確認されました。
IPO7を介したコア蛋白質の核移行が、感染性ウイルスの細胞外への放出に寄与することを明らかにしました。
■ 背景
蚊などの節足動物により媒介されるフラビウイルスは、日本脳炎ウイルス(JEV)やデングウイルス(DENV)、ジカウイルス(ZIKV)、ウエストナイルウイルス(WNV)といったウイルスが知られており、いずれもヒトに病気を起こすウイルスです。特にDENVは毎年4億人が感染しており、東南アジアや南米を含めた多くの地域で流行しています。さらに近年では、国内でも流行地域から帰国した後に発症する輸入感染例も報告されていることが問題となっています。しかしながら、現在も有効な治療薬がないため、フラビウイルスによる病気を発症した場合には対症療法が取られています。したがって、JEVやDENV、ZIKVなど広範に抗ウイルス効果を示す治療薬の開発が望まれています。
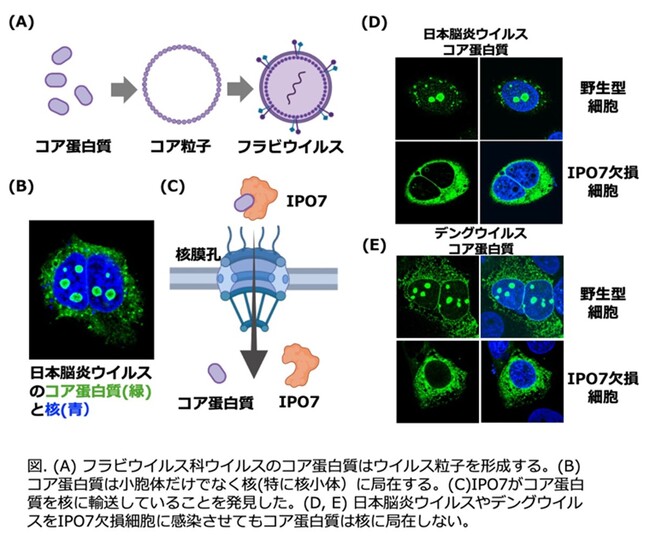
先行研究において、JEV、DENV、ZIKV、WNVのウイルス粒子を形成するコア蛋白質(図A)は、細胞質だけでなく核にも局在することが古くから知られていました(図B、J Virol (2005))。このようなフラビウイルスに共通したコア蛋白質の核局在は、広範なフラビウイルスに効果を示す治療薬の標的になると考えられます。実際、我々は以前、フラビウイルスコア蛋白質の核局在を阻害する化合物を複数同定し、これらの化合物がJEVだけでなく、DENVやZIKVの増殖を抑制することを発見しました(Virology (2020))。しかしながら、フラビウイルスのコア蛋白質が核に局在する生理的意義や核移行の分子メカニズムは不明なままでした。
以上の経緯を踏まえ、フラビウイルスのコア蛋白質の核移行に寄与する宿主因子を同定するとともに、フラビウイルスの増殖における核局在の意義を明らかにするため、検討を行いました。
■ 内容
コア蛋白質を核に輸送する宿主因子(感染した細胞に存在する因子)を探索するため、質量分析によりJEVのコア蛋白質に結合する宿主因子を検出したところ、インポーチンβファミリー(※3)に属するIPO7を同定することに成功しました(図C)。さらにIPO7を欠損した細胞を作製し、ウイルス感染におけるコア蛋白質の局在を検討したところ、核移行が阻害され、多くが細胞質に局在することが示されました。この現象は、JEVだけでなくDENV、ZIKV、WNVなど他のフラビウイルスでも確認されたことから、IPO7がフラビウイルスに共通したコア蛋白質の核輸送運搬体であることが明らかになりました (図D、E)。次に、IPO7欠損によるコア蛋白質の核移行阻害がウイルスの増殖に与える影響を検討したところ、IPO7の欠損はウイルスの増殖を有意に阻害することが明らかになりました。最後にコア蛋白質の核局在の意義を検討するため、JEV、DENV、ZIKVのコア蛋白質を持つ一回感染性のウイルス様粒子(SRIP)(※4)を野生型の細胞とIPO7欠損細胞で作製し、できたSRIPの感染性を評価しました。その結果、IPO7欠損細胞で作製されたSRIPの感染性は顕著に低下しました。これらのことから、IPO7を介したコア蛋白質の核局在は、感染性ウイルス粒子の細胞外への放出に重要であることが明らかになりました。
■ 研究成果の意義
本研究では、フラビウイルスのコア蛋白質が宿主因子であるIPO7を介して核に移行し、感染性ウイルスの細胞外への効率的な放出に寄与していることを世界に先駆けて明らかにしました。これまで、フラビウイルスのコア蛋白質が核に局在する生理的意義は分かっていませんでしたが、本研究で得られた成果により、フラビウイルスのライフサイクルの理解がさらに深まると考えられます。また、広範なフラビウイルスでIPO7欠損によるコア蛋白質の核局在阻害やウイルス産生の抑制が確認されたことから、様々なフラビウイルスに効果を示す治療薬の標的となり得る可能性を示すことができ、IPO7を標的とした治療薬の開発が期待されます。
■ 用語解説
※1 フラビウイルス
蚊やダニなどの節足動物により媒介されるウイルス。日本脳炎ウイルスやデングウイルス、ジカウイルスなどが含まれる。これらのウイルスは時に重篤な疾患を引き起こし、デングウイルスによる出血熱、妊娠中のジカウイルス感染が胎児の小頭症を発症させることが知られている。
※2 コア蛋白質
ウイルスのカプシドを構成する蛋白質。ウイルス粒子の内部に存在しているカプシドと呼ばれる殻の中にウイルスゲノムを包んでおり、エンベロープの内側に存在している。
※3 インポーチンβファミリー
多くの蛋白質は、核膜孔を介して核と細胞質間を移動することができる。インポーチンβファミリーは、核―細胞質間輸送因子であり、多くの蛋白質の核内外への輸送に関与している。
※4 一回感染性ウイルス様粒子(SRIP)
通常のウイルスと異なり、産生されたウイルス様粒子は1回のみ細胞に感染することができる。したがって、SRIPを感染させると培養上清にはウイルス様粒子は含まれず、そのウイルス様粒子の感染能力を評価することができる。
■ 特記事項
本研究は、日本医療研究開発機構(AMED) 新興・再興感染症に対する革新的医薬品等開発推進研究事業「新しいイメージング技術による節足動物媒介フラビウイルスの治療薬開発に資する研究開発」、日本学術振興会、科学研究費助成事業・基盤研究B、ベーリンガーインゲルハイムの研究支援を受けて実施されました。なお、本研究にご協力いただいた皆様には深謝いたします。
■ 論文情報
本研究はPLoS Pathogens誌のオンライン版に2024年8月15日付で公開されました。
タイトル: Importin-7-dependent nuclear translocation of the Flavivirus core protein is required for infectious virus production.
タイトル(日本語訳): フラビウイルス科ウイルスのコア蛋白質によるIPO7依存的核移行は感染性ウイルスの放出に関与する
著者: Yumi Itoh1¶, Yoichi Miyamoto2,3¶, Makoto Tokunaga4, Tatsuya Suzuki1, Akira Takada4, Akinori Ninomiya5, Tomomi Hishinuma1, Mami Matsuda6, Yoshihiro Yoneda7, Masahiro Oka2, Ryosuke Suzuki6, Yoshiharu Matsuura8*, Toru Okamoto1*
著者(日本語表記): 伊東祐美1)、宮本洋一2,3)、徳永詢4)、鈴木達也1)、高田晶4)、二宮彰紀5)、菱沼知美1)、松田麻未6)、米田悦啓7)、岡正啓2)、鈴木亮介6)、松浦善治8)、岡本徹1)
著者所属:1)順天堂大学微生物学講座、2) 国立研究開発法人医薬基盤・健康・栄養研究所 細胞核輸送ダイナミクスプロジェクト、3)国立研究開発法人医薬基盤・健康・栄養研究所 生体機能分子制御プロジェクト、4)大阪大学微生物病研究所高等共創研究院、5)大阪大学微生物病研究所中央実験室、6)国立感染症研究所ウイルスII部、7)一般財団法人阪大微生物病研究会、8)大阪大学感染症総合教育研究拠点
DOI: 10.1371/journal.ppat.1012409
企業プレスリリース詳細へ
PR TIMESトップへ
― 広範なフラビウイルスに対する治療標的としての可能性を示唆 ―
順天堂大学大学院医学研究科微生物学の伊東祐美助教、岡本徹主任教授らは、国立研究開発法人医薬基盤・健康・栄養研究所生体機能分子制御プロジェクトの宮本洋一主任研究員との共同研究により、広範なフラビウイルス(※1)で保存されているコア蛋白質(※2)の核局在の意義および核移行のメカニズムを検討し、1.フラビウイルスのコア蛋白質を核に輸送する因子としてインポーチン7(Importin-7:IPO7)を同定し、2.IPO7を介したコア蛋白質の核移行が感染性ウイルスの細胞外への放出に重要であることを明らかにしました。研究成果は、国際科学誌PLOS Pathogens誌に、2024年8月15日午後2時(米国東部夏時間)にオンライン版で発表されました。
■ 本研究成果のポイント
フラビウイルス科ウイルスに共通のコア蛋白質の核移行を担う因子としてIPO7を同定しました。
IPO7がない細胞では、コア蛋白質の核移行の阻害および感染性ウイルス粒子の産生抑制が、日本脳炎ウイルスだけでなくデングウイルスやジカウイルスでも確認されました。
IPO7を介したコア蛋白質の核移行が、感染性ウイルスの細胞外への放出に寄与することを明らかにしました。
■ 背景
蚊などの節足動物により媒介されるフラビウイルスは、日本脳炎ウイルス(JEV)やデングウイルス(DENV)、ジカウイルス(ZIKV)、ウエストナイルウイルス(WNV)といったウイルスが知られており、いずれもヒトに病気を起こすウイルスです。特にDENVは毎年4億人が感染しており、東南アジアや南米を含めた多くの地域で流行しています。さらに近年では、国内でも流行地域から帰国した後に発症する輸入感染例も報告されていることが問題となっています。しかしながら、現在も有効な治療薬がないため、フラビウイルスによる病気を発症した場合には対症療法が取られています。したがって、JEVやDENV、ZIKVなど広範に抗ウイルス効果を示す治療薬の開発が望まれています。
先行研究において、JEV、DENV、ZIKV、WNVのウイルス粒子を形成するコア蛋白質(図A)は、細胞質だけでなく核にも局在することが古くから知られていました(図B、J Virol (2005))。このようなフラビウイルスに共通したコア蛋白質の核局在は、広範なフラビウイルスに効果を示す治療薬の標的になると考えられます。実際、我々は以前、フラビウイルスコア蛋白質の核局在を阻害する化合物を複数同定し、これらの化合物がJEVだけでなく、DENVやZIKVの増殖を抑制することを発見しました(Virology (2020))。しかしながら、フラビウイルスのコア蛋白質が核に局在する生理的意義や核移行の分子メカニズムは不明なままでした。
以上の経緯を踏まえ、フラビウイルスのコア蛋白質の核移行に寄与する宿主因子を同定するとともに、フラビウイルスの増殖における核局在の意義を明らかにするため、検討を行いました。
■ 内容
コア蛋白質を核に輸送する宿主因子(感染した細胞に存在する因子)を探索するため、質量分析によりJEVのコア蛋白質に結合する宿主因子を検出したところ、インポーチンβファミリー(※3)に属するIPO7を同定することに成功しました(図C)。さらにIPO7を欠損した細胞を作製し、ウイルス感染におけるコア蛋白質の局在を検討したところ、核移行が阻害され、多くが細胞質に局在することが示されました。この現象は、JEVだけでなくDENV、ZIKV、WNVなど他のフラビウイルスでも確認されたことから、IPO7がフラビウイルスに共通したコア蛋白質の核輸送運搬体であることが明らかになりました (図D、E)。次に、IPO7欠損によるコア蛋白質の核移行阻害がウイルスの増殖に与える影響を検討したところ、IPO7の欠損はウイルスの増殖を有意に阻害することが明らかになりました。最後にコア蛋白質の核局在の意義を検討するため、JEV、DENV、ZIKVのコア蛋白質を持つ一回感染性のウイルス様粒子(SRIP)(※4)を野生型の細胞とIPO7欠損細胞で作製し、できたSRIPの感染性を評価しました。その結果、IPO7欠損細胞で作製されたSRIPの感染性は顕著に低下しました。これらのことから、IPO7を介したコア蛋白質の核局在は、感染性ウイルス粒子の細胞外への放出に重要であることが明らかになりました。

■ 研究成果の意義
本研究では、フラビウイルスのコア蛋白質が宿主因子であるIPO7を介して核に移行し、感染性ウイルスの細胞外への効率的な放出に寄与していることを世界に先駆けて明らかにしました。これまで、フラビウイルスのコア蛋白質が核に局在する生理的意義は分かっていませんでしたが、本研究で得られた成果により、フラビウイルスのライフサイクルの理解がさらに深まると考えられます。また、広範なフラビウイルスでIPO7欠損によるコア蛋白質の核局在阻害やウイルス産生の抑制が確認されたことから、様々なフラビウイルスに効果を示す治療薬の標的となり得る可能性を示すことができ、IPO7を標的とした治療薬の開発が期待されます。
■ 用語解説
※1 フラビウイルス
蚊やダニなどの節足動物により媒介されるウイルス。日本脳炎ウイルスやデングウイルス、ジカウイルスなどが含まれる。これらのウイルスは時に重篤な疾患を引き起こし、デングウイルスによる出血熱、妊娠中のジカウイルス感染が胎児の小頭症を発症させることが知られている。
※2 コア蛋白質
ウイルスのカプシドを構成する蛋白質。ウイルス粒子の内部に存在しているカプシドと呼ばれる殻の中にウイルスゲノムを包んでおり、エンベロープの内側に存在している。
※3 インポーチンβファミリー
多くの蛋白質は、核膜孔を介して核と細胞質間を移動することができる。インポーチンβファミリーは、核―細胞質間輸送因子であり、多くの蛋白質の核内外への輸送に関与している。
※4 一回感染性ウイルス様粒子(SRIP)
通常のウイルスと異なり、産生されたウイルス様粒子は1回のみ細胞に感染することができる。したがって、SRIPを感染させると培養上清にはウイルス様粒子は含まれず、そのウイルス様粒子の感染能力を評価することができる。
■ 特記事項
本研究は、日本医療研究開発機構(AMED) 新興・再興感染症に対する革新的医薬品等開発推進研究事業「新しいイメージング技術による節足動物媒介フラビウイルスの治療薬開発に資する研究開発」、日本学術振興会、科学研究費助成事業・基盤研究B、ベーリンガーインゲルハイムの研究支援を受けて実施されました。なお、本研究にご協力いただいた皆様には深謝いたします。
■ 論文情報
本研究はPLoS Pathogens誌のオンライン版に2024年8月15日付で公開されました。
タイトル: Importin-7-dependent nuclear translocation of the Flavivirus core protein is required for infectious virus production.
タイトル(日本語訳): フラビウイルス科ウイルスのコア蛋白質によるIPO7依存的核移行は感染性ウイルスの放出に関与する
著者: Yumi Itoh1¶, Yoichi Miyamoto2,3¶, Makoto Tokunaga4, Tatsuya Suzuki1, Akira Takada4, Akinori Ninomiya5, Tomomi Hishinuma1, Mami Matsuda6, Yoshihiro Yoneda7, Masahiro Oka2, Ryosuke Suzuki6, Yoshiharu Matsuura8*, Toru Okamoto1*
著者(日本語表記): 伊東祐美1)、宮本洋一2,3)、徳永詢4)、鈴木達也1)、高田晶4)、二宮彰紀5)、菱沼知美1)、松田麻未6)、米田悦啓7)、岡正啓2)、鈴木亮介6)、松浦善治8)、岡本徹1)
著者所属:1)順天堂大学微生物学講座、2) 国立研究開発法人医薬基盤・健康・栄養研究所 細胞核輸送ダイナミクスプロジェクト、3)国立研究開発法人医薬基盤・健康・栄養研究所 生体機能分子制御プロジェクト、4)大阪大学微生物病研究所高等共創研究院、5)大阪大学微生物病研究所中央実験室、6)国立感染症研究所ウイルスII部、7)一般財団法人阪大微生物病研究会、8)大阪大学感染症総合教育研究拠点
DOI: 10.1371/journal.ppat.1012409
企業プレスリリース詳細へ
PR TIMESトップへ
(2024/08/16 11:00)
- データ提供
-

本コーナーの内容に関するお問い合わせ、または掲載についてのお問い合わせは株式会社 PR TIMES ( )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
 )までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
)までご連絡ください。製品、サービスなどに関するお問い合わせは、それぞれの発表企業・団体にご連絡ください。
























