2025/06/23 17:55
ISHA 2025へようこそ!
ISHA – 国際股関節保存学会は、2025年10月2日から4日まで、日本の…
東京慈恵会医科大学エクソソーム創薬研究講座の藤田雄講師、内科学講座呼吸器内科の藤本祥太助教、荒屋潤教授、桑野和善講座担当教授、外科学講座呼吸器外科の大塚崇講座担当教授、東京医科大学医学総合研究所分子細胞治療研究部門の落谷孝広教授らの研究グループは、加齢とともに発症率が高まる肺疾患である特発性肺線維症(idiopathic pulmonary fibrosis: IPF)に高率に合併する肺がんの悪性化に関わる要因が、IPFの病態において重要な老化した線維芽細胞が分泌するエクソソーム(細胞外小胞)により促されていることを発見しました。
体内における線維化は、肝臓や肺などのさまざまな臓器で生じることが知られています。これらは高率にがんを合併することから、臓器線維症の病態理解や新規の治療法開発はがんを予防、早期発見する上でも非常に重要であると認識されています。特にIPFは、診断後平均生存期間も3-5年の難病で、有効な治療法が十分確立されていません。さらに、肺がんを合併するIPF患者は、肺がんを合併しないIPF患者と比較しても、予後が悪いことも分かっています。本研究グループは先行研究にて、老化した線維芽細胞が分泌するエクソソームが、IPF病態の悪化に関与する気道上皮細胞老化を促進することを発見注1しており、今回の発見では、同様の線維芽細胞由来エクソソームが、合併するがんの増悪を促進させることを明らかにしました。これにより、IPFに合併する肺がん病態のより詳細な解明につながり、ひいては新たな治療開発へとつながることが期待されます。
この研究成果は、米国呼吸器学会が発刊する「American Journal of Respiratory Cell and Molecular Biology」オンライン版に掲載されました(日本時間 2023年2月28日公開).
【概要】
●IPFの病態における線維芽細胞(lung fibroblasts: LFs)は、筋線維芽細胞化注2および老化の形質を持つ細胞(IPF-LFs)であり、これらが分泌するエクソソームに着目し、肺がんに対する影響を解析しました。
●IPF-LFsが分泌するエクソソームは、添加実験にて肺がん細胞株の増殖を有意に促進させました。
●種々の解析により、IPF-LFsが分泌するエクソソームに内包されるマイクロRNA-19a注3が、肺がんに取り込まれZMYND11を直接制御し、その下流のがん遺伝子であるc-Mycのシグナルを活性化することがメカニズムであることが考えられました。
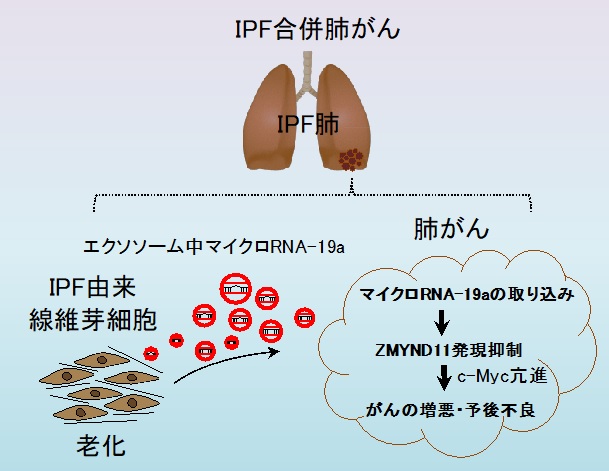
図1
研究結果概略図
1. 背景
特発性肺線維症(IPF)は、慢性かつ進行性の線維化に伴う呼吸機能低下と呼吸苦を呈する、原因不明の難病疾患です。国内では、約13,000〜15,000人の患者さんがいると言われていますが、初期や早期は自覚症状のないケースもあり、潜在的な数はそれ以上と考えられています。またIPFは、加齢とともにその発症率が上昇する老化関連肺疾患であり、IPF肺では老化した気道上皮細胞や線維芽細胞が多く存在し、これらが老化関連分泌因子(SASPs)の分泌を介して組織修復遅延や慢性炎症を誘導し病態増悪につながることが、昨今の研究から分かってきました。IPFは、診断後の平均生存期間が3-5年と短く、治療薬は抗線維化薬であるピルフェニドンとニンテダニブの2剤が臨床現場で使用されていますが、未だに予後が不良な疾患として知られています。さらに、IPFでは高率に肺がんを合併することが知られており、がんの合併したIPF患者の予後は極めて不良であることが報告されています。
エクソソームは脂質二重膜に囲まれた100nm前後の細胞外小胞で、マイクロRNAやタンパク質など多彩な分子を内包し、組織修復や再生、疾患の発症や進展など、多くの機能や病態に関与することが知られています。本研究チームは、IPFにおいてその病態進展に関与する線維芽細胞に着目し、それらから分泌されるエクソソームによる肺がんへの影響を解析し、IPF自身や合併する肺がんに対する新たな治療戦略となる研究を目指しました。
2.研究手法・成果
(i) 老化した IPF患者由来線維芽細胞が分泌するエクソソームは、肺がんの増殖を促進する。
IPF患者およびnon-IPF患者に由来するヒト手術肺検体から線維芽細胞(LFs)を分離培養しました。IPF患者由来の線維芽細胞(IPF-LFs)とnon-IPF患者由来の線維芽細胞(non IPF-LFs)を比較検討したところ、IPF-LFsは肺の線維化病態形成および進展に重要な線維芽細胞から筋線維芽細胞への分化形質を有しており、さらに細胞老化がnon IPF-LFsよりも有意に誘導されていることが判明しました。この筋線維芽細胞化および老化の形質をもつIPF-LFsの分泌するエクソソームの機能を詳細に解析するために、超遠心法注4でエクソソームを回収しました(図2A)。これらエクソソームを肺がん細胞株であるA549およびH460細胞に添加したところ、IPF-LF由来エクソソームは有意にがん細胞の増殖を促進させることを見だしました(図2B)。
図2
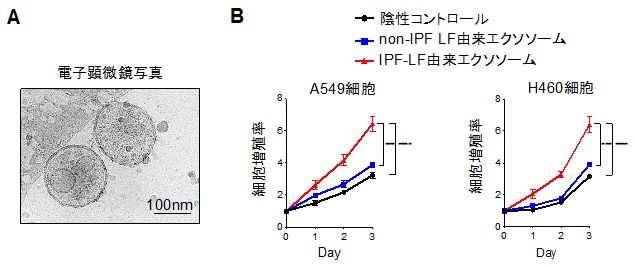
A: 肺線維芽細胞由来のエクソソームの電子顕微鏡写真。
B: エクソソームの肺がん細胞株への添加による細胞増殖の変化(***P<0.001, ****P<0.0001)。
(ii) IPF患者由来線維芽細胞が分泌するエクソソーム中のマイクロRNA-19aが肺がん増殖促進に関与する。
老化した IPF-LF由来エクソソームによる肺がん増殖促進のメカニズムを検討しました。エクソソームは多彩な分子を内包し複数のメカニズムで作用します。そこで、IPF-LF由来エクソソームに含まれる分子を検討しました。網羅解析などの結果、内包物の中でも特にマイクロRNA-19aが、肺がん細胞の増殖において重要であることが判明しました。マイクロRNA-19aはこれまでの報告などからも、肺がん細胞で有意に発現が増加するがん関連マイクロRNAであり、がんゲノムデータベースであるThe Cancer Genome Atlas(TCGA) 注5を用いた解析においても、肺がんの予後に関わる重要な因子であることが分かりました。
(iii) エクソソームで移送されたマイクロRNA-19aは、ZMYND11/c-Mycシグナルにより肺がん悪性化に関与する。
IPF患者由来線維芽細胞が分泌するエクソソーム中のマイクロRNA-19aが、肺がん細胞に取り込まれたのち、どのようなメカニズムでがんの悪性化が誘導されるのか探索しました。網羅解析などの結果から、マイクロRNA-19aはZMYND11という遺伝子を直接抑制制御していることが判明しました。ZMYND11はヒストン注6の修飾部位と結合し、転写伸長に関与する因子であり、下流のがん遺伝子の転写抑制に関与していることが報告されています。実際に肺がん腫瘍サンプルでZMYND11の発現を評価してみると、IPFに合併した肺がんではZMYND11の発現は低下していることも分かりました(図3)。さらに、ZMYND11は、複数のがん遺伝子を制御しており、特にc-Mycというがん遺伝子の発現が、マイクロRNA-19a/ZMYND11の経路で活性化され肺がん悪性化に関与することが判明しました。
図3
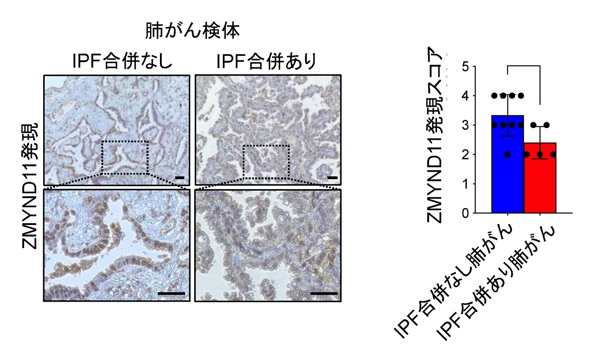
IPF合併肺がん腫瘍検体を用いたZMYND11の免疫染色の結果(スケールバー100μm)、および免疫染色発現スコア(*P<0.05)。IPF合併肺がん検体では、IPF合併なしと比較して、核内のZMYND11(茶色)の染色レベルが低下している。
3.今後の展開
本研究グループは、IPFに合併する肺がんの予後が悪い要因として、老化したIPF患者由来線維芽細胞が分泌するエクソソームによって促されていることを突き止めました(図1:研究結果概略図)。IPF患者由来線維芽細胞が分泌するエクソソーム自身、または内包するマイクロRNA-19aを阻害することは、IPFの病態のみならず、合併する肺がんの悪性化制御にもつながる新しい治療戦略となる可能性があります。
また本知見は、肺疾患のみならず、さまざまな臓器線維症に高頻度に合併する多様ながんの悪性化メカニズムの解明にもつながります。今後、さまざまな臓器に認められる線維化病変とがんとのつながりを解析することにより、新たながん治療への応用が期待されます。
4.脚注、用語説明
注1.Kadota T, Yoshioka Y, Fujita Yu, Araya J, Minagawa S, Hara H, Miyamoto A, Suzuki S, Fujimori S, Kohno T, Fujii T, Kishi K, Kuwano K, Ochiya T. Extracellular Vesicles from Fibroblasts Induce Epithelial-Cell Senescence in Pulmonary Fibrosis. Am J Respir Cell Mol Biol. 2020, 63(5):623-636.
注2.筋線維芽細胞化: 損傷組織の修復・再生・恒常性維持のために,組織の線維芽細胞が分化すること。
注3.マイクロRNA: 遺伝子ゲノム上にコードされ、20から25塩基長で構成される微小RNA。機能性核酸であり、他の遺伝子の発現の調整を行うことで、生体内のさまざまな現象に重要な役割を担っている。マイクロRNA-19aのそのうちの一つ。
注4.超遠心法: エクソソームの現時点で最も標準的な回収方法。
注5.TCGA: The Cancer Genome Atlasの略で、米国主導の大規模ながんゲノム解析プロジェクト。ゲノム、トランスクリプトーム、エピジェネティックな修飾など、がんのゲノムについて包括的な理解を目指し解析を進めている。
注6.ヒストン: クロマチンの基本単位であるヌクレオソームを構成する塩基性タンパク質。ヒストンのメチル化やアセチル化修飾が起こると遺伝子発現が活性化または不活性化する。
5. 論文タイトル,著者
掲載誌名: American Journal of Respiratory Cell and Molecular Biology
論文タイトル: Fibroblast-derived Extracellular Vesicles Induce Cancer Progression in the IPF Microenvironment
https://doi.org/10.1165/rcmb.2022-0253OC
著者:Yu Fujita1,2+*, Shota Fujimoto1+, Atsushi Miyamoto3, Reika Kaneko2, Tsukasa Kadota1, Naoaki Watanabe1, Ryusuke Kizawa1,2, Hironori Kawamoto1, Junko Watanabe1, Hirofumi Utsumi1, Hiroshi Wakui1, Shunsuke Minagawa1, Jun Araya1, Takashi Ohtsuka4, Takahiro Ochiya5, Kazuyoshi Kuwano1
著者(日本語表記):藤田雄1,2+*, 藤本祥太1+, 宮本篤3, 金子麗華2, 門田宰1, 渡邉直昭1, 木澤隆介1,2, 川本浩徳1, 渡部淳子1, 内海裕文1, 和久井大1, 皆川俊介1, 荒屋潤1, 大塚崇4, 落谷孝広5, 桑野和善1
+共同第一著者, *責任著者
1. 東京慈恵会医科大学内科学講座呼吸器内科
2. 東京慈恵会医科大学エクソソーム創薬研究講座
3. 国家公務員共催組合連合会虎の門病院呼吸器内科
4. 東京慈恵会医科大学外科学講座呼吸器外科
5. 東京医科大学医学総合研究所分子細胞治療研究部門
6. 主な研究資金
科学研究費助成事業 若手研究 19K17649 研究代表者:藤田雄
科学研究費助成事業 基盤研究(B) 21H02930 研究代表者:藤田雄
科学研究費助成事業 基盤研究(B) 22H03082 研究代表者:荒屋潤
以上
(2023/03/01 14:21)
2025/06/23 17:55
ISHA 2025へようこそ!
ISHA – 国際股関節保存学会は、2025年10月2日から4日まで、日本の…
2025/06/06 12:24
第14回日本認知症予防学会学術集会
この度、第14回日本認知症予防学会学術集会の大会長を拝命いたしま…